 |
Главная |
Тема 10: Коррозия металлов
|
из
5.00
|
Коррозия – это самопроизвольно протекающий процесс разрушения металлов при контакте их с окружающей средой или электролитами.
Различают химическую и электрохимическую коррозии. Химическая коррозия протекает при непосредственном контакте металла с окислителем в средах, не проводящих электрический ток (сухие газы, неэлектролиты), и не сопровождается возникновением его. Более распространена электрохимическая коррозия, которая обусловлена образованием микрогальванических элементов, вследствие содержания в металлах вкраплений других металлов или контакта с другими металлами.
В природных водах, влаге, сконденсированной на поверхности металлического изделия, содержится растворенный кислород, углекислый газ и некоторые соли. Углекислый газ в растворе создает повышенную, по сравнению с чистой водой, концентрацию ионов Н+, которые вместе с кислородом являются сильными окислителями.
Например, при контакте железа с медью образуется гальваническая пара, в которой отрицательным полюсом (анодом) будет железо, а положительным (катодом) – медь.
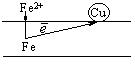 Анодный процесс:
Анодный процесс:
Fe - 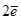 = Fe2+
= Fe2+
Катодный процесс:
1) кислая среда: 2Н+ + 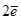 = Н2
= Н2
2) нейтральная или слабо щелочная среда: О2 + 2Н2О + 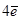 = 4ОН-
= 4ОН-
Образовавшиеся ионы Fe2+ будут взаимодействовать с ионами гидроксида ОН- : Fe2+ + 2ОН- = Fe(OH)2
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3. Fe(OH)3, теряя молекулу воды, превращается в ржавчину.
Какой из двух контактирующих металлов будет подвергаться окислению (разрушению, коррозии) зависит от активности металлов, что может быть установлено по ряду напряжений металлов.
Коррозия наносит значительный ущерб, поэтому защита металлов от коррозии имеет важное народнохозяйственное значение. Одним из способов защиты металлов от коррозии является нанесение на металлические изделия защитных покрытий. Различают неметаллические (лаки, краски, пленки) и металлические покрытия. Последние делятся на катодное и анодное покрытия.
Катодным называется покрытие металла слоем менее активного металла. Например, луженое железо. При нарушении покрытия, железо как более активный металл в образовавшейся гальванопаре будет анодом (отрицательным полюсом).
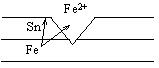 Fe – 2e = Fe+
Fe – 2e = Fe+
Олово будет катодом (положительным полюсом), поэтому покрытие называется катодным. На его поверхности будет восстанавливаться вода:
2Н2О + 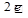 = Н2 + 2ОН- или 2Н2О + О2 +
= Н2 + 2ОН- или 2Н2О + О2 + 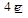 =4ОН
=4ОН
Продуктом коррозии будет Fe(OH)2 → Fe(OH)3. Причем железо будет разрушаться более интенсивно, чем в отсутствии покрытия. Анодным называется покрытие металла слоем более активного металла. Например, оцинкованное железо. В этом случае анодом будет цинк. Катодом будет железо, на его поверхности будут протекать процессы восстановления воды или других анионов.
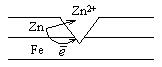 Zn -
Zn - 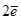 =Zn2+
=Zn2+
2H2O + 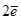 = H2 + 2OH-
= H2 + 2OH-
Продуктом коррозии будет Zn(OH)2. Металлическое изделие окажется защищенным до полного разрушения покрытия, поэтому анодное покрытие более эффективно защищает изделия по сравнению с катодным.
Часто для защиты крупных сооружений, трубопроводов и т.д. используется электрохимическая защита, которая подразделяется на протекторную и электрозащиту.
Контрольные задания:
181. Почему химически чистый цинк обнаруживает большую химическую стойкость против коррозии, чем технический цинк? Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии технического цинка в кислой среде.
182. Магниевая пластинка, соединенная с оловянной, опущена в соляную кислоту. Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии пластинки.
183. В чем заключается принцип применения протекторной защиты от коррозии? Составьте электронные уравнения анодного и катодного процессов, протекающих при протекторной защите никеля в воде, содержащей растворенный кислород.
184. Медь не вытесняет водорода из разбавленных кислот, однако, если к медной пластинке, опущенной в кислоту, прикоснуться цинковой пластинкой, то на поверхности медной пластинки начинает выделяться водород. Объясните это явление, составьте электронные уравнения анодного и катодного процессов, а также схему образовавшегося микрогальванического элемента.
185. Изделие из технического железа находится под дождем. Напишите электронные уравнения анодного и катодного процессов коррозии, а также составьте схему коррозионного микрогальванического элемента.
186. Цинковая пластинка, спаянная с железной, опущена в разбавленную серную кислоту. Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии пластинки, а также схему данного гальванического элемента.
187. Какое покрытие металла называют катодным и какое анодным? Перечислите металлы, которые могут быть использованы для катодного покрытия железа. Напишите электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого свинцом, при нарушении покрытия в сильнокислотной среде. Составьте схему образовавшегося коррозионного гальванического элемента.
188. Какое покрытие металла называют катодным и какое анодным? Перечислите металлы, которые можно использовать для анодного покрытия железа. Напишите электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого цинком, во влажном воздухе при нарушении покрытия.
189. Два кусочка цинка одинаковой массы находятся в контакте с медью и свинцом в растворе соляной кислоты. Какой из них растворится быстрее? Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии. Составьте схемы образованных коррозионных гальванических элементов.
190. Никелевую деталь покрыли свинцом. Какое это покрытие – катодное или анодное? Напишите электронные уравнения анодного и катодногопроцессов коррозии этой детали во влажном воздухе при повреждении покрытия.
191. Две железные пластинки, частично покрыты одна оловом, другая свинцом. На какой из них быстрее образуется ржавчина во влажном воздухе? Составьте электронные уравнения анодного и катодного процессов.
192. Железное изделие покрыто никелем. Какое это покрытие – катодное или анодное? Напишите электронные уравнения анодного и катодного процессов, протекающих при коррозии изделия во влажном воздухе при нарушении покрытия. Составьте схему образовавшегося коррозионного гальванического элемента.
193. В раствор соляной кислоты опустили кусочек чистого железа и железа, частично покрытого оловом. Масса железа в обоих случаях одинакова. В каком случае железо растворится быстрее? Напишите электронные уравнения анодного и катодного процессов коррозии железа.
194.В воду, содержащую растворенный кислород, опустили железную пластинку, частично покрытую медью. В каком случае ржавчина образуется быстрее? Составьте электронные уравнения анодного и катодного процессов коррозии железа.
195. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
196. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте уравнения анодного и катодного процессов.
197.Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
198. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако, если цинковой палочкой прикоснуться к железной пластине, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте уравнения анодного и катодного процессов.
199.В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
200. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний – никель. Какие продукты коррозии образуются в первом и во втором случаях?
Тема 11: Углеводороды
Углеводороды – это простейшие органические вещества, молекулы которых состоят из атомов только двух элементов: C и H.
Предельными называют углеводороды, в молекулах которых атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода.
Предельные углеводороды имеют общую формулу 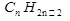 .Все углеродные атомы предельных углеводородов находятся в состоянии
.Все углеродные атомы предельных углеводородов находятся в состоянии 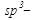 гибридизации, дают одинарные s-связи.
гибридизации, дают одинарные s-связи.
Простейшим представителем предельных углеводородов является метан 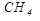 . Группы органических соединений можно объединить в гомологические ряды. Каждый член гомологического ряда отличается на группу
. Группы органических соединений можно объединить в гомологические ряды. Каждый член гомологического ряда отличается на группу 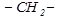 , называемую гомологический разностью. Для названия углеводорода по международной номенклатуре ИЮПАК (эта система применяется и для других классов органических соединений) выбирается наиболее длинная цепь углеродных атомов и нумеруется начиная с того конца, к которому ближе расположен радикал. Затем называется номер углеродного атома, с которым связан заместитель (начиная с простейшего); в конце пишется название углеводорода, которому соответствует длинная цепь. Если один и тот же радикал в боковой цепи встречается несколько раз, то перед ним ставят приставку ди-, три-, тетра- и т.д., чтобы указать число этих радикалов, а положение каждого из них обозначают цифрами.
, называемую гомологический разностью. Для названия углеводорода по международной номенклатуре ИЮПАК (эта система применяется и для других классов органических соединений) выбирается наиболее длинная цепь углеродных атомов и нумеруется начиная с того конца, к которому ближе расположен радикал. Затем называется номер углеродного атома, с которым связан заместитель (начиная с простейшего); в конце пишется название углеводорода, которому соответствует длинная цепь. Если один и тот же радикал в боковой цепи встречается несколько раз, то перед ним ставят приставку ди-, три-, тетра- и т.д., чтобы указать число этих радикалов, а положение каждого из них обозначают цифрами.
Схема, отображающая химические свойства предельных углеводородов:
 Галагениро
Галагениро  вание
вание
Г (Cl2, Br2) CnH2n+1Г + HГ
Термическое разложение
 CmH2m+2 + CpH2p (где n = m + p)
CmH2m+2 + CpH2p (где n = m + p)
CnH2n+2  Дегидрирование
Дегидрирование
 - H2 H2 + RCH = CHR' (R – радикал)
- H2 H2 + RCH = CHR' (R – радикал)
Горение
 + O2 nCO2 + (n+1)H2O
+ O2 nCO2 + (n+1)H2O
Непредельными называют такие углеводороды, в молекулах которых не все связи атомов углерода насыщены, т.е. между ними имеются двойные и тройные связи.
Непредельные углеводороды с одной двойной связью – алкены (этиленовые углеводороды, олефины). Гомологический ряд непредельных углеводородов ряда этилена имеет общую формулу 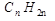 .
.
По международной номенклатуре окончание –ан для предельных углеводородов заменяют в названиях непредельных углеводородов на –ен. Выбирают углеводородную цепь, включающую двойную связь (если даже она не является самой длинной), и нумеруют начиная с того конца, где ближе всего расположена двойная связь. В конце названия ставят цифру, указывающую углеродный атом при двойной связи.
Схемы, отражающие химические свойства и получение этиленовых углеводородов:
Горение

 + O2 nCO2 + nH2O
+ O2 nCO2 + nH2O
Гидрирование
 H2 CnH2n+2
H2 CnH2n+2
Галогенирование
 Г2 CnH2nГ2 (Г2 — Сl, Br, I)
Г2 CnH2nГ2 (Г2 — Сl, Br, I)
Гидрогалогенирование
 CnH2n HГ CnH2n+1Г
CnH2n HГ CnH2n+1Г
Гидратация
 H2O (катализатор) CnH2n+1OH
H2O (катализатор) CnH2n+1OH
Дегидрирование
 катализатор CnH2n-2 + H2
катализатор CnH2n-2 + H2
Полимеризация | |
 p, t0, катализатор (— C — C — )n
p, t0, катализатор (— C — C — )n
| |
Дегидрирование

 CnH2n+2 - H2, катализатор
CnH2n+2 - H2, катализатор
Дегидрогалогенирование
 CnH2n+1Г - HГ (спирт, р-р KOH) CnH2n
CnH2n+1Г - HГ (спирт, р-р KOH) CnH2n
 Дегидратация
Дегидратация
 CnH2n+1OH - H2O (H2SO4 (конц.))
CnH2n+1OH - H2O (H2SO4 (конц.))
Непредельные углеводороды с двумя двойными связями, или диеновые углеводороды.
В молекулах диеновых углеводородов возможно различное расположение двух двойных связей: у одного углеродного атома (= С =) — так называемые кумулированные двойные связи; две двойные связи в молекуле разделены одной простой (— С = С — С = С —) — сопряженная связь. Характерной особенностью углеводородов этого ряда является их способность легко полимеризоваться. Свойства этих полимеров во многом похожи на свойства натурального каучука.
Для диеновых углеводородов с сопряженными связями характерны следующие реакции:
1,2 присоединение CH3 — CH2 — CH = CH2



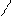 гидрирование
гидрирование
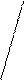
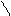 1,4 присоединение CH3 — CH = CH — CH3
1,4 присоединение CH3 — CH = CH — CH3
1,2 присоединение СН2 — СH — CH = CH2

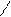 CH2 = CH — CH = CH2 галогенирование | |
CH2 = CH — CH = CH2 галогенирование | |

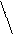
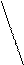 Г2 Г Г
Г2 Г Г
1,4 присоединение CH2 — CH = CH — CH2
 | |
| |
полимеризация Г Г


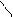 1,4 положение (— CH2 — CH = CH —CH2 —)n
1,4 положение (— CH2 — CH = CH —CH2 —)n
Непредельные углеводороды с тройной связью — алкины.
Простейшим представителем ряда алкинов является ацетилен C2H2 или H — C ≡ C — H Из ацетилена путем замещения в его молекуле атомов водорода можно получить другие члены гомологического ряда углеводородов с одной тройной связью. Их общая формула CnH2n-2.
По международной наменклатуре названия ацетиленовых углеводородов происходят от названия соответствующих алканов, в которых окончание -ан заменяется на -ин, положение тройной связи обозначается в конце.
Схема, отражающая химические свойства ацетиленовых углеводородов:
 Гидрирование H2
Гидрирование H2
 H2 R — CH = CH2 ® R — CH2 — CH3
H2 R — CH = CH2 ® R — CH2 — CH3
Г Г
Галогенирование Г2 | |
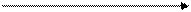 Г2 R — C = CH ® R — C — CH
Г2 R — C = CH ® R — C — CH
| |
Г Г
Г
Гидрогалагенирование HГ |
 HГ R — C = CH2 ® R — C — CH3
HГ R — C = CH2 ® R — C — CH3
 R — C ≡ CH | |
R — C ≡ CH | |
Г Г
H2O [Hg2+]
 R — C — CH3
R — C — CH3
||
O
 R
R

 Тримеризация
Тримеризация


 R R
R R
Замещение
 [Ag(NH3)2]OH R — C ≡ CAg
[Ag(NH3)2]OH R — C ≡ CAg
Контрольные задания:
201.Напишите формулы нижеследующих углеводородов:
а) 2,2-диметил-гексан; б) 2,3-диметил-3-этил-гексан;
в) 2,3,4-триметил-пентан; г) 2,5-диметил-3,3-диэтил-гексан;
д) 2,2,3,4-тетраметил-гексан; е) 2,4,4,5-тетраметил-гептан.
202. Назовите по систематической номенклатуре следующие углеводороды:
а) CH3 — CH2 — CH — CH — CH2 — CH3 б) CH3 — CH — CH — CH2 — CH — CH3
| | | | |
СH3 — CH CH — CH3 CH3 CH3 CH3 — C — CH3
| | |
CH3 CH3 CH3
в) CH2 = C — CH2 — CH — CH3 г) CH3 CH3
| | | |
СH3 CH3 CH3 — C = C — CH —CH3 |
CH2
|
CH3
д) CH3 е) CH3
| |
СH ≡ C — CH — CH — CH3 CH3 — CH — C ≡ C — C — CH3
| | |
CH2 — CH3 CH3 CH3
203. У каких из следующих веществ могут быть изомеры: C3H6Cl2, CH3Cl, C2H4Cl2, C3H5CHCl2? Назовите по систематической номенклатуре все соединения. Ответ обоснуйте структурными формулами.
204. Как можно получить пропан и бутан, если даны следующие вещества: метан, металлический натрий, хлор? Укажите условия проведения реакций.
205.При помощи каких реакций можно осуществить следующие превращения:
а) CH4 ® CH3Cl ® C2H6 ® C2H5Cl ® C3H8; б) C ® CH4 ® CH3Cl ® C3H8 ® C3H7Br.
206. Какие олефины могут быть получены при дегидрировании: а) изобутана;
б) диметилэтилметана; в) 2-метилпентана; г) пропана? Напишите сокращенные структурные формулы.
207. Напишите реакции взаимодействия:
а) брома и 2-метил-3-бутена; б) хлора и 2,4-диметил-2-пентена;
в) перманганата калия в щелочном или нейтральном растворе и 2,2-диметил-3-пентена.
Назовите образующиеся соединения. Какие из этих реакций используются как качественные на непредельную связь?
208.Напишите реакции присоединения:
а) бромистого водорода к пропилену; б) иодистого водорода к 2-метил-2-бутену;
в) хлористого водорода при действии его на 2,2,4-триметилпентен-3.
Назовите образующиеся соединения и объясните каждую реакцию.
209.Напишите реакции присоединения йодистого водорода при действии его на:
а) 2-метилгексен-3; б) 2-метилгексен-2; в) гексен-3.
В каких из этих реакций не имеет значения правило Марковникова? В какой из них возможно образование смеси двух изомерных галогенпроизводных? Назовите образующиеся соединения.
210. Напишите реакции окисления в присутствии KMnO4 (реакция Вагнера) в слабощелочной среде и окисления к кислой среде с распадом молекул по месту двойной связи следующих соединений:
а) гексен-3; б) 2-метилбутен-2; в) 3-метилпентен-2; г) 2,2-диметилпентен-3.
211. Напишите схемы полимеризации: а) этилена; б) пропилена; в) изобутилена. Как называются образующиеся полимеры? Чем различается строение их цепей?
212. Напишите схемы реакции получения этиленовых углеводородов из галогенпроизводных:
а) 2-хлорпентана; б) 3-хлорпентана; в) 3-хлоргексана.
В каком случае следует ожидать образование смеси изомерных этиленовых углеводородов и почему? Назовите образующиеся углеводороды.
213. Напишите реакции присоединения:
а) брома и этилацетилена; б) хлора и бутин-2; в) брома и 2,5-диметилгексин-3.
Назовите образующиеся галогенпроизводные. Какая реакция используется как качественная на кратную связь?
214. Напишите и объясните реакции ступенчатого присоединения при действии:
а) хлористого водорода на 3-метилпентин-1; б) бромистого водорода на 4-метилбутин-2;
в) йодистого водорода на гексин-3.
Назовите образующиеся галогенпроизводные. В каком случае следует ожидать смеси изомерных соединений?
215. Напишите реакции гидратации ацетиленовых углеводородов (реакция Кучерова), взяв в качестве исходных следующие соединения:
а) ацетилен; б) бутин-1; в) 2,2-диметилпентин-4.
216.Какие из перечисленных ниже углеводородов способны образовать ацетиленид:
а) бутилацетилен; б) 2-метилпентин-4; в) 2-метилпентин-3; г) пропин.
Напишите соответствующие реакции с аммиачным раствором окиси серебра.
217.Какими реакциями можно различить изомерные соединения: пентадиен-1,3,
2-метилбутадиен-1,3, пентин-1, пентин-2?
218.Напишите схему превращений и укажите реагенты, необходимые для получения бутадиена-1,3 из бутена-1.
219. Как из метана можно получить бензол? Напишите для бензола реакции (с образованием однозамещенных производных):
а) бромирования; б) нитрования; в) сульфирования.
Назовите образующиеся соединения.
220. Предложите три пути синтеза пропилбензола из бензола.
|
из
5.00
|
Обсуждение в статье: Тема 10: Коррозия металлов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

