 |
Главная |
P - 6 электронов, f – 14 электронов
|
из
5.00
|
К О Н Т Р О Л Ь Н А Я Р А Б О Т А
П О Х И М И И
Фамилия И. О. Иванов Иван Иванович
Факультет: Филиал СЗТУ в г. Удомля
Специальность: 140101.65 «Тепловые и атомные электростанции»
Шифр: 0102030033
Задача N 1
Определите символы элементов и найдите величины, помеченные знаком “?” в табл. 1. Составьте электронные и электронно-графические формулы для атомов соответствующего элемента в основном состоянии.
| Номер задачи | Символ элемента | Атомный номер элемента | массовое число | число протонов | число нейтронов |
| ? | ? | ? |
Решение
Атомный (порядковый) номер химического элемента определяет заряд ядра его атомов. Ядро атома построено из нуклонов: протонов (заряд +1, масса 1) и нейтронов (заряд 0, масса 1). Следовательно, заряд ядра атома есть суммарный заряд его протонов (нейтроны заряда не несут), а массовое число – суммарная масса протонов и нейтронов. Поскольку и заряды, и массы этих частиц имеют единичные значения, то от них можно легко перейти непосредственно к числу частиц.
Таким образом, число протонов в ядре численно совпадает с атомным (порядковым) номером элемента в периодической системе Д.И. Менделеева. Число нейтронов можно вычислить по разности между массовым числом и числом протонов. Массовое число указывается верхним индексом слева от символа элемента.
Для указанного в условии задачи элемента:
| Символ элемента | атомный номер (порядковый номер) | заряд ядра | массовое число | число протонов | число нейтронов |
| Мо | +42 |
Суммарный отрицательный заряд электронов в атоме компенсирует положительный заряд его ядра. Следовательно, число электронов в атоме равно числу протонов в его ядре.
Для рассматриваемого в задаче элемента .. Мо …….. число электронов составляет: 42....
Электронная формула атома - это условная запись, в которой зашифровано распределение электронов данного атома по энергетическим уровням и подуровням. Энергетические подуровни заполняются электронами в порядке, соответствующем росту их энергии:
S-2s-2p-3s-3p-4s-3d-4p-5s-4d-5p-6s-4f-5d-6p-7s-5f-6d...
 |
Максимальная емкость подуровней:
S – 2 электрона, d - 10 электронов,
p - 6 электронов, f – 14 электронов
Электронная формула атома рассматриваемого элемента имеет вид:
…1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d4………………………………
При составлении электронно-графической формулы необходимо каждый энергетический подуровень представить графически как совокупность квантовых ячеек:
s-подуровень
p-подуровень
d-подуровень
f-подуровень
Значение спинового квантового числа mS: условно обозначается с помощью стрелки, направление которой определяется его знаком: (+1/2) и¯ (-1/2).
Распределение электронов по квантовым ячейкам происходит в соответствии с правилом Хунда: суммарное спиновое число электронов данного подуровня должно быть максимальным (по возможности каждому электрону следует предоставлять отдельную квантовую ячейку и только поместив во все имеющиеся ячейки по одному электрону, приступать к «подселению» второго электрона).
Два электрона, сосуществующие в одной и той же квантовой ячейке, должны обладать противоположными значениями спинового квантового числа (следствие из принципа Паули): ¯
Электроны атома элемента .Mo...….. распределены по квантовым ячейкам следующим образом (в основном, т.е. отвечающем его минимальной энергии, состоянии):
 
|
 
|
 
|  
|  
|
 
|
 
|  
|  
|
 
|


1 s2 2 s2 2 p6 3 s2 3 p6 4 s2
 
|  
|  
|
 
|

| 
| 
| 
|










3 d10 4 p6 5 s2 4 d4
Задача N 2
На основании положения химического элемента № 51 и его электронной формулы составьте прогноз его химических свойств, ответив на следующие вопросы:
1. В каких периоде, группе и подгруппе располагается данный элемент в периодической системе Д.И. Менделеева?
2. Укажите соответствие между положением элемента в периодической системе Д.И. Менделеева и его электронной формулой (номером внешнего энергетического уровня, общим числом валентных электронов, характером их распределения по энергетическим подуровням).
3. К какому электронному семейству относится данный элемент?
4. Охарактеризуйте валентные состояния атомов данного элемента в основном и возбужденных состояниях с помощью электронно-графических формул.
5. Чему равны максимальная и минимальная степени окисления атомов этого элемента?
6. Каковы формулы высшего оксида и соответствующего гидроксида этого элемента?
Решение
Данный элемент располагается в периодической системе в периоде № 5 , в группе № V, в главной (главной или побочной) подгруппе.
Электронная формула элемента имеет вид:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s24d10 5p3
Номер внешнего энергетического уровня ( n = 5) соответствует номеру периода. Общее число валентных электронов (электронов внешнего энергетического уровня, а также предвнешнего d-подуровня, если он застроен неполностью) для большинства элементов соответствует номеру группы.
Валентные электроны данного элемента: 5s2 p3 (выписать их из электронной формулы), их общее число = 5, что соответствует номеру группы ( V ).
Принадлежность элементов к главным или побочным подгруппам определяется типом электронного семейства:
s- и p-элементы составляют главные подгруппы,
d- и f-элементы образуют побочные подгруппы.
Классификация химических элементов по электронным семействам основана на характере застройки электронных оболочек. В соответствии с ним элементы подразделяются на следующие электронные семейства:
- s-элементы (застройка внешнего s-подуровня, все внутренние слои застроены);
- p-элементы (застройка внешнего p-подуровня, все внутренние слои застроены);
- d-элементы (застройка предпоследнего d-подуровня);
- f-элементы (застройка третьего снаружи f-подуровня).
Исходя из указанной классификации элемент Sb принадлежит к p -электронному семейству и находится в периодической системе в главной подгруппе (VА).
Валентные состояния атомов определяются наличием одиночных неспаренных валентных электронов (спиновая валентность).
Для определения спиновой валентности элемента в основном (т.е. отвечающем его минимальной энергии) распределяем его валентные электроны по квантовым ячейкам в соответствии с принципом Паули и правилом Хунда:
 
|

| 
| 
|
5s2 5p3
Число одиночных неспаренных валентных электронов равно 3.
Кроме представленного выше основного состояния атома можно представить возбужденные состояния, в которые атом переходит при получении им дополнительных порций энергии, и которые характеризуются переходами электронов из занятых ячеек в свободные в пределах данного уровня, что проявляется в изменении спиновой валентности элемента. Если свободные квантовые ячейки на данном энергетическом уровне отсутствуют, то возбужденные состояние невозможны, и спиновая валентность в таком случае постоянна.
Возбужденные состояния для атома рассматриваемого в задаче элемента можно отобразить следующими схемами:

|

| 
| 
|

|
Sb*
Значения спиновой валентности для каждого из них: 5
Высшую (максимальную) степеньокисления атом приобретает, отдав все свои валентные электроны. Поэтому для большинства элементов максимальная степень окисления равна номеру группы, в которой находится данный элемент в таблице Д.И. Менделеева.
Следовательно, для элемента Sb максимальная степень окисления составляет: + 5 .
Низшая (минимальная) степень окисления соответствует числу электронов, необходимых атому для достройки внешнего электронного слоя до октета восьмиэлектронной структуры). Поэтому минимальную степень окисления можно вычислить по формуле: Nгруппы - 8.
Однако, присоединение электронов свойственно только атомам типичных неметаллов, поэтому для металлов и переходных элементов минимальная степень окисления равна нулю.
Рассматриваемый в задаче элемент Sb проявляет минимальную степень окисления (-3).
Зная величины максимальной и минимальной степени окисления атомов элементов, можно составить формулы их соединений.
Оксиды - это соединения элементов с кислородом. Общая формула оксида: ЭmOn (Э-символ элемента, О - символ кислорода, числа m и n показывают количественное соотношение между атомами элементов). Кислород проявляет минимальную степень окисления -2 (элемент VI группы).
Поэтому для обеспечения электронейтральности химической формулы необходимо подобрать следующие соотношения m:n для указанного в задаче элемента: Sb:О=2:5 .и формула его оксида имеет вид: Sb 2 О5
Гидроксиды - это основания (для типичных металлов и d-элементов, если их атомы находятся в степени окисления не выше +3) и кислоты (для типичных неметаллов и d-элементов в степенях окисления >3).
Общая формула основания: Me(OH)n (n < 3, n = 3), при этом число гидроксильных групп (ОН-) соответствует валентности металла.
Для элемента, приведенного в условии задачи, формула основания имеет вид: …-…
( если элемент не образует оснований, поставьте прочерк).
Наиболее распространенные кислоты, в состав которых входят атомы элементов в максимальной степени окисления, имеют общую формулу HmЭO4.
Используя значения степеней окисления атомов (H+1, O-2, и высшей степени окисления элемента Э), составляем формулу кислоты: H3SbO4 (если элемент не образует кислот, поставьте прочерк).
Для кислот с m = 3 или 4 (орто-кислоты) возможно отщепление молекулы воды (- H2O) и образование второй формы кислоты - мета-формы.(H m-2 ЭO3)
Для данного элемента образование мета-кислоты возможно (возможно или невозможно), ее формула: HSbO3
Задача N 3
Определите тип химической связи (неполярная ковалентная, полярная ковалентная или ионная) в веществах……CBr4……….……. и ……… BaBr2…………… В случае полярной или ионной связи укажите направление смещения электронов. В случае ковалентной (полярной или неполярной) связи постройте электронные схемы молекул (теория Льюиса) и определите кратность связи, постройте схемы перекрывания электронных орбиталей (метод ВС) и определите геометрическую форму молекулы.
Решение:
Электроотрицательность (EN) характеризует способность атомов элементов к смещению электронной плотности. В периоде системы элементов Д. И. Менделеева она возрастает слева направо, в подгруппе убывает сверху вниз (для s- и p-элементов).
Тип химической связи (неполярная ковалентная, полярная ковалентная или ионная), образующейся в результате взаимодействия атомов АиВ, можно установить по величине разности электроотрицательностей DEN этих атомов:
· - если она равна (или близка к) нулю, то электронная плотность распределена симметрично между атомами, химическая связь является неполярной ковалентной; такая связь наиболее характерна для молекул, образованных атомами одного и того же элемента.
· - если она не равна нулю, но невелика (взаимодействуют атомы элементов-неметаллов), химическая связь относится к типу полярной ковалентной; при этом электронная плотность смещается от менее электроотрицательного атома А (положительный полюсА+ ) к более электроотрицательному В(отрицательный полюсВ- ).
· - если она крайне велика (во взаимодействие вступают атом элемента А-типичного металла и атом элементаВ-типичного неметалла), происходит передача электронов от менее электроотрицательного атома (он превращается в положительно заряженный ионАm+) к более электроотрицательному атому ( он превращается в отрицательно заряженный ионВn-). Процесс передачи электронов можно отобразить с помощью уравнений:
A0 - m e = Am+
В0+ n e = Вn-
Электростатическое притяжение между разноименно заряженных ионов называют ионной связью.
Для рассматриваемых в задаче веществ:
1.) разность электроотрицательностей атомов элементов .C.. и…Br...различна (0,3) (близка к нулю, различна, крайне различна), т.к. один из них неметалл....(металл или неметалл), а второй неметалл....(металл или неметалл),
2.) разность электроотрицательностей атомов элементов ..Ba.….. и …Br....... крайне различна (1,9).......(близка к нулю, различна, крайне различна), т.к. один из них . металл.............(металл или неметалл), а второй неметалл.........(металл или неметалл),
поэтому типы химической связи: в этих веществах:
1.) .. полярная ковалентная.............................
2.) … ионная...........................
В случае ионной связи ( вещество ... BaBr2.........) уравнения переходов нейтральных атомов в ионы:
............. Ba.0 - 2е = Ba.2+ .............................................................................
........... Br0 + 1е = Br1-.................................................................................
В случае ковалентной связи необходимо представить электронную схему молекулы (теория Льюиса) и схему перекрывания электронных орбиталей (метод ВС).
Согласно простейшим представлениям о механизме образования ковалентной связи (теория Льюиса), атомы обобщают свои валентные электроны, достраивая свою электронную оболочку до октета (8 электронов) – конфигурации благородных газов. Исключение составляет атом водорода, способный достроить свою электронную оболочку лишь до двух электронов (электронная конфигурация атома гелия). Электронная схема молекулы показывает, сколько электронов обобщают атомы, при этом электрон изображается точкой.
Число общих электронных пар между двумя атомами определяет кратность ковалентной связи: одна пара - одинарная, две пары - двойная, три пары - тройная.
Для построения электронной схемы необходимо:
1. определить общее число валентных электронов каждого атома по номеру группы в периодической системе Д.И. Менделеева,
2. выяснить, сколько электронов не достает каждому из них до октета,
3. построить схему обобщения, изображая электроны в виде точек
.
Электронная схема молекулы … CBr4.........., в состав которой входит атом элемента .С.... (..4..... группа периодической системы Д.И. Менделеева), имеющий ..4.... валентных электронов, и атом элемента .. Br......., представителя группы N ..7...., имеющий ..7..... валентных электронов, выглядит следующим образом:
. .
: Br :
. . . . . .
: Br : С : Br :
. . . . . .
: Br :
. .
Поскольку в результате обобщения электронов между каждой парой атомов образовалось ..1..... общих электронных пар, то кратность данной ковалентной связи в молекуле ...... равна ..1... .
Электронная схема молекулы ….........., в состав которой входит атом элемента ..... (....... группа периодической системы Д.И. Менделеева), имеющий ...... валентных электронов, и атом элемента ........., представителя группы N ......, имеющий ........ валентных электронов, выглядит следующим образом:
Поскольку в результате обобщения электронов между каждой парой атомов образовалось ....... общих электронных пар, то кратность данной ковалентной связи в молекуле ...... равна ..... .
Одна из квантово-механических интерпретаций механизма образования ковалентной связи - метод ВС - предусматривает изображение схемы перекрывания орбиталей, соответствующих одиночным (неспаренным) валентным электронам каждого из атомов. Для построения данной схемы необходимо:
- составить электронные формулы атомов, образующих данную молекулу:
· -выбрать валентные электроны (электроны внешнего, последнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен неполностью):
· -распределить эти электроны по квантовым ячейкам (таким образом, чтобы наибольшее число ячеек было занято электронами), символизируя электрон со значением спинового квантового числа стрелкой, направленной вверх а электрон с ms = -1/2 стрелкой, направленной вниз ¯.
· найти одиночные (неспаренные) валентные электроны и определить орбитали, которые им соответствуют;
· нарисовать схему перекрывания орбиталей.
Если неспаренные валентные электроны атома занимают разныеподуровни, то в образовании ковалентной связи участвуют не «чистые» s- и p-орбитали, а их гибриды. Гибридные орбитали образуются в результате геометрического сложения обычных орбиталей (сферической s–орбитали и симметричной гантелеобразной р-орбитали) и представляют собой усредненные по форме орбитали (несимметричная гантелеобразная орбиталь, одна из лопастей которой увеличена по сравнению с исходной, а другая уменьшена по сравнению с исходной). Число гибридных орбиталей равно числу исходных s– и р-орбиталей. Тип гибрида (sp, sp2, sp3) указывает число и вид исходных орбиталей. Взаимное расположение гибридных орбиталей в пространстве должно обеспечивать максимальную симметрию:
| Исходные орбитали | тип гибрида | Число Гибридных орбиталей | Геометрическая форма молекулы | |||||
| Sp | две |  линейная линейная
| |||||
|
| Sp2 | три |  равносторонний
треугольник равносторонний
треугольник
| |||||
| Sp3 | четыре |  тетраэдр тетраэдр
|
 
|

| 
|
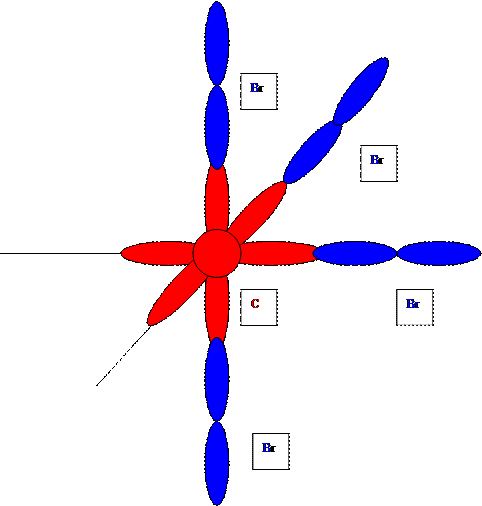
· -схема перекрывания орбиталей для молекулы ... CBr4..........:

| 
|

|

 
|
 
|  
| 
|
С 2 s2 2 p2 C* В = 4
Br 4 s2 4 p5
геометрическая форма молекулы: sp3 – гибридизация, тетраэдрическая
· -схема перекрывания орбиталей для молекулы .............:
геометрическая форма молекулы: ................................
Задача N 4
Вычислите стандартные величины DH0298, DS0298 и DG0298 для реакции:

 …HCHO(r) H2(r) + CO(r)
…HCHO(r) H2(r) + CO(r)
Объясните знак изменения энтальпии и энтропии. Возможно ли самопроизвольное протекание данной реакции при стандартных условиях?
Решение
H (энтальпия), S (энтропия) и G (свободная энергия Гиббса или термодинамический потенциал) являются термодинамическими функциями состояния и обладают общим свойством: их изменение в ходе химической реакции не зависит от пути этой реакции, а определяется только начальными и конечными веществами. Это позволяет вычислять DH, DS, DG для реакции общего вида aA + bB = cC + dD по формулам:
DH0 = (cDH0C + dDH0D) - (aDH0A + bDH0B)
DS0 = (cS0C + dS0D) - (aS0A + bS0B)
DG0 = (cDG0C + dDG0D) - (aDG0A + bDG0B),
где
DH0C, DH0D, DH0A, DH0B - стандартные энтальпии образования веществ C, D, A, B (см. ДОТ_Химия_2.2. Опорный конспект_Справочные материалы );
S0C, S0D, S0A, S0B - стандартные энтропии веществ C, D, A, B (см. ДОТ_Химия_2.2. Опорный конспект_Справочные материалы) ;
DG0C, DG0D, DG0A, DG0B - стандартные свободные энергии образования веществ C, D, A, B.
Величину DG0 можно вычислить по формуле:
DG0 = DH0 - T DS0
(при этом для стандартных условий T = 298 К).
Для реакции, указанной в условии задачи, выписываем необходимые справочные данные:
DH0А. =. – 115,90..................................... S0 А = 218,78...............................................................................................
DH0 В..= 0 .................................................. ..... S0 В = 0 .........................………....................................................................
DH0 С....= 0,00 ..................................... ..... S0 С = 130,52................………................................................................
DH0 D....= - 110,53 ......................... .... ..... S0 D = 197,55 ..……………..................................................................
DH0 = (DH0H2 + DH0CО) - (DH0HCHO) = (0,00 +(-110,53)) –
((-115,90)+ 0 ) = (-110,53) - (-115,90) = 5,37 кДж
DS0 = (S0 H2 + S0 CО ) - (S0 HCHO ) = (130,52 + 197,55)- (218,78 + 0 ) =
328,07 – 218,78 = 109,29 Дж/К = 0,109 кДж/К[1]
DG0 = DH0 - 298 * DS0 = - 27,112 кДж
Изменения термодинамических функций H, S, G в ходе химической реакции позволяют судить об особенностях протекания данной реакции и ее природе.
DH определяет величину теплового эффекта химической реакции. Процесс, характеризующийся величиной DH<0, происходит с выделением тепла и относится к разряду экзотермических. DH>0 говорит о том, что тепло в ходе реакции поглощается, такие реакции называются эндотермическими.
В данной реакции величина DH > 0, следовательно, тепло поглощается, и реакция является эндотермической.
DS характеризует изменение степени неупорядоченности системы.
Возрастание энтропии (DS0>0) говорит о возрастании неупорядоченности в расположении и перемещении частиц в ходе химической реакции. Это происходит, например, при превращении твердых веществ в жидкие или газообразные или при увеличении количеств газообразных веществ. Напротив, уменьшение энтропии (DS0<0) cвидетельствует о возрастании упорядоченности системы в ходе реакции. Уменьшение энтропии характерно для реакций, в ходе которых, например, газообразные или жидкие вещества превращаются в твердые, а также для газовых реакций, сопровождающихся уменьшением количеств газообразных веществ.
Для данной реакции рассчитанная величина изменения энтропии DS0 > 0, что свидетельствует об увеличении (увеличении или уменьшении?) неупорядоченности в данной системе. Действительно, из уравнения реакции видно, что в ходе реакции из ..1........моль газообразных веществ HCHO(r) образуется .....2....моль газообразных веществ… H2(r) и CO(r) , следовательно, степень неупорядоченности увеличивается (увеличивается или уменьшается?).
Величина DG0 позволяет судить о принципиальной возможности самопроизвольного протекания химической реакции при стандартных условиях: если DG0 < 0, данная химическая реакция принципиально осуществима при стандартных условиях, если же DG0 > 0, то нет (в этом случае осуществима обратная реакция). Состояние химического равновесия в системе отвечает равенству DG0 = 0.
Для рассматриваемой в задаче реакции вычисленная величина DG0 составляет
- 27,112 кДж, т.е. DG0 < 0. Следовательно, данная химическая реакция при стандартных условиях принципиально осуществима (осуществима или не осуществима).
Задача N 5
Для реакции:

 HCHO(r) H2(r) + CO(r)
HCHO(r) H2(r) + CO(r)
· составьте кинетическое уравнение;
· составьте выражение для константы равновесия;
· вычислите, во сколько раз изменится скорость реакции при заданных изменениях:
1. температуры,
2. общего давления (при изменении объема системы),
3. концентраций реагентов
· укажите, как необходимо изменить внешние параметры (температуру, общее давление, концентрации реагентов), чтобы сместить равновесие вправо.
| Номер задачи | Порядок по 1-му реагенту | Порядок по 2-му реагенту | γ | Т1, К | Т2, К | 
| 
| 
|
| - | 2,8 | - |
Решение
Химическая реакция может быть охарактеризована скоростью ее протекания.
Скорость химической реакции зависит от многих факторов, среди которых:
· - природа реагирующих веществ;
· - температура;
· - концентрация реагирующих веществ;
· - присутствие катализаторов.
|
из
5.00
|
Обсуждение в статье: P - 6 электронов, f – 14 электронов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

