 |
Главная |
Правило знаков ЭДС элементов и электродных потенциалов
|
из
5.00
|
1. Основополагающее правило – ЭДС положительна, если внутри гальванического элемента положительное электричество (катионы) перемещается слева направо (Стокгольм, международная конференция 1953г.)
2. Выводы. При разряде ионов на правом электроде - процесс восстановления (электрод заряжается положительно), а сам электрод – положительный полюс г.э. (катод); на левом электроде – процесс окисления (отрицательный полюс, анод).
3. Соответствие знака ЭДС системе знаков теории хим. сродства а) 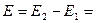

б)  и
и  , самопроизвольный процесс
, самопроизвольный процесс
53. Электрохимическая форма уравнения Гиббса-Гельмгольца. Зависимость ЭДС гальванического элемента от температуры. Температурный коэффициент ЭДС и его связь с энтропией химической реакции в гальваническом элементе.
Уравнение Гиббса-Гельмгольца применительно к электрохимической цепи:
 Если
Если 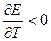 , то химическая реакция протекающая в элементе, может быть только экзотермической;
, то химическая реакция протекающая в элементе, может быть только экзотермической;
 , то реакция также может быть только экзотермическая;
, то реакция также может быть только экзотермическая;
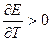 , то химическая реакция в элементе может быть как экзо-, так и эндотермической.
, то химическая реакция в элементе может быть как экзо-, так и эндотермической.
n - число электронов участвующих в электрохимической реакции;
ΔG – изменение энергии Гиббса для химической реакции, протекающей в гальваническом элементе.
Производная ΔG по температуре дает значения энтропии ΔS:


где ΔS - изменение энтропии для химической реакции, протекающей в гальваническом элементе;
 - температурный коэффициент э.д.с.
- температурный коэффициент э.д.с.
Измерив э.д.с. элемента и ее температурный коэффициент, можно найти ΔG и ΔS для суммарного процесса, протекающего в элементе.
Изменение энтальпии для химической реакции в элементе вычисляют, используя уравнение Гиббса-Гельмгольца:
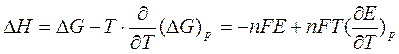

Классификация электродов. Окислительно-восстановительные электроды, потенциал которых не зависит от концентрации ионов водорода. Приведите пример, электродную реакцию и уравнение Нернста для расчёта потенциала электрода указанного типа.
Классификация:
1) Электроды 1-го рода
2) Электроды 2-го рода
3) Электроды 3-го рода
4) Газовые электроды
5) Ионоселективные электроды
6) Окислительно-восстановительные электроды
Про окислительно-восстановительные электроды см. 60!!!
Электроды первого рода. Примеры. Вывод и анализ уравнения, связывающего потенциал электрода с активностями потенциалопределяющих ионов.
См. п.56

Электроды первого рода, обратимые по катиону: определение, примеры, уравнение, связывающее потенциал электрода с активностями веществ, участников электродной полуреакции (уравнение Нернста). Амальгамные электроды.
Электрод первого рода – это металл (или неметалл), погруженный в раствор, содержащий ионы этого же металла (неметалла).

Таким образом, потенциал электрода первого рода определяется активностью катионов металла в растворе или активностью анионов неметалла. Ионы, от активности которых непосредственно зависит потенциал электрода, называются потенциалопределяющими.
Примерами электродов первого рода, обратимых по катиону, могут служить металлы в растворах их растворимых солей (Ag в растворе AgNO3, Cu в растворе CuSO4).
Так, для серебряного электрода Ag+|Ag электродная реакция имеет вид: Ag+ +е =Ag
Электродный потенциал определяется выражением:
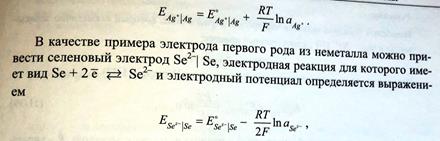

АМАЛЬГАМНЫЕ ЭЛЕКТРОДЫ

Приведите пример электрода второго рода. Запишите электродную реакцию и уравнение Нернста для выбранного электрода. Влияние концентрации потенциалопределяющих ионов на потенциал электрода.
Электрод второго рода – металл, покрытый слоем его малорастворимого соединения (соли/оксида/гидроксида) и погруженный в раствор электролита, который содержит тот же анион, что и малорастворимое соединение.

Таким образом, потенциал электрода второго рода определяется активностью анионов: такие электроды обратимы по аниону.
Электрод, представляющий собой ртуть, покрытую пастой из смеси каломели Hg2Cl2 cо ртутью, находящуюся в контакте с раствором хлорида калия: Cl-| Hg2Cl2|Hg, называют каломельным электродом.

Ввиду низкой растворимости каломели в воде активность хлорид-ионов считают практически равной активности хлорид-ионов, образуемых при диссоциации хлорида калия, поэтому концентрация хлорида калия в растворе должна быть точно известна. Наиболее часто используют каломельные электроды, в которых концентрация KCl отвечает насыщению (насыщенный) или равна 0,1 или 1,0 моль/л. Каломельные электроды (особенно насыщенный) удобны тем, что диффузионный потенциал, возникающий в электрохимической цепи на границе насыщенный раствор хлорида калия – данный раствор, незначителен и во многих случаях (не требующих большой точности) им можно пренебречь.

Потенциалы электродов зависят, в первую очередь, от соотношения активностей (концентраций) потенциалопределяющих ионов в растворе. Увеличение концентрации окисленной формы (или уменьшение концентрации восстановленной формы) приводит к возрастанию потенциала электрода. Вместе с тем, ионы (вещества), не участвующие в электродных реакциях (индифферентные), изменяют ионную силу раствора, а, следовательно, и коэффициент активности и активность потенциалопределяющих ионов. Это опять же приводит к изменению потенциала электрода. Те вещества, которые вступают в химическое взаимодействие с потенциалопределяющими ионами, также влияют на потенциалы электродов.
|
из
5.00
|
Обсуждение в статье: Правило знаков ЭДС элементов и электродных потенциалов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

