 |
Главная |
Окислительно-восстановительные электроды: определение, примеры, электродные полуреакции. Вывод и анализ уравнения Нернста для электродов данного типа.
|
из
5.00
|
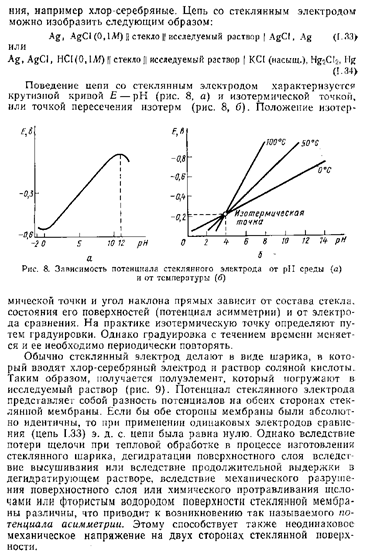
Окислительно-восстановительные электроды (редокс-электроды) – система из химически инертного металла, погруженного в раствор, содержащий окисленную и восстановленную формы элемента.
Для окислительно-восстановительных электродов характерно, что в процессе их работы катионы и анионы, изменяя степень окисления, не выделяются на электроде из химически инертного металла. Металлический проводник в данном случае является лишь «посредником» в передаче электронов от одной формы элемента к другой. Обычно в качестве металлического проводника используют платину, реже – ртуть, золото.
Потенциалы окислительно-восстановительных электродов зависят, в первую очередь, от соотношения активностей (концентраций) потенциалопределяющих ионов в растворе. Увеличение концентрации окисленной формы (или уменьшение концентрации восстановленной формы) приводит к возрастанию потенциала электрода. Вместе с тем, ионы (вещества), не участвующие в электродных реакциях (индифферентные), изменяют ионную силу раствора, а, следовательно, и коэффициент активности и активность потенциалопределяющих ионов. Это опять же приводит к изменению потенциала электрода. Те вещества, которые вступают в химическое взаимодействие с потенциалопределяющими ионами, также влияют на потенциалы электродов.
Для оценки влияния различных веществ на потенциалы электродов составляются гальванические элементы, содержащие электрод сравнения.
Окислительно-восстановительные электроды можно разделить на простые и сложные.
| Простые | Cложные |
Электродная реакция сводится к изменению заряда ионов без изменения их состава:
Fe3+ + e = Fe2+
Fe(CN)63- + e = Fe(CN)64-
В общем виде:
Ох + ze = Red
Схема простого окислительно-восстановительного электрода:
Red, Ox | Pt
EOx,Red = EoOx,Red +  ln ln 
| Реакции протекают с изменением заряда реагирующих частиц и их состава (в таких реакциях обычно участвуют ионы Н+, ОН- и молекулы воды).
Примеры сложные окислительно-восстановительных электродов:
1) В электродной реакции обмен электронами протекает между анионами и катионами, в состав которых входит один и тот же металл.
Схема: MnO4-, Mn2+, H+|Pt
MnO4- +8H+ + 5e = Mn2+ + H2O,
EMnO4-, Mn2+, H+ = EoMnO4-, Mn2+, H+ + 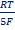 ln ln 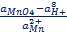 Т.е. электродный потенциал зависит не только от соотношения активностей окисленной и восстановленной форм элемента, но и от кислотности среды.
2) В окислительно-восстановительной реакции участвует одно или несколько твердых веществ:
Схема: MnO4-, H+, MnO2(тв)|Pt
MnO4- +4H+ + 3e = MnO2 + 2H2O
EMnO4-, H+, MnO2 = EoMnO4-, H+, MnO2+
Т.е. электродный потенциал зависит не только от соотношения активностей окисленной и восстановленной форм элемента, но и от кислотности среды.
2) В окислительно-восстановительной реакции участвует одно или несколько твердых веществ:
Схема: MnO4-, H+, MnO2(тв)|Pt
MnO4- +4H+ + 3e = MnO2 + 2H2O
EMnO4-, H+, MnO2 = EoMnO4-, H+, MnO2+  ln(a4H+aMnO4-)
3) Хингидронный электрод
С6Н4О2*С6Н4(ОН)2 = С6Н4О2 + С6Н4(ОН)2
Хинон (Ox) Гидрохинон (H2R)
С6Н4О2 + 2H+ + 2e = С6Н4(ОН)2
EOx,H+,H2R = Eo Ox,H+,H2R + ln(a4H+aMnO4-)
3) Хингидронный электрод
С6Н4О2*С6Н4(ОН)2 = С6Н4О2 + С6Н4(ОН)2
Хинон (Ox) Гидрохинон (H2R)
С6Н4О2 + 2H+ + 2e = С6Н4(ОН)2
EOx,H+,H2R = Eo Ox,H+,H2R + 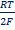 ln ln 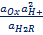 В приближенной теории хингидронного электрода считают, что концентрация хинона и гидрохинона в растворе примерно одинаковы и коэффициенты активности этих соединений имеют близкие значения, то и их активности одинаковы. При этом уравнение упрощается:
EOx,H+,H2R = Eo Ox,H+,H2R +
В приближенной теории хингидронного электрода считают, что концентрация хинона и гидрохинона в растворе примерно одинаковы и коэффициенты активности этих соединений имеют близкие значения, то и их активности одинаковы. При этом уравнение упрощается:
EOx,H+,H2R = Eo Ox,H+,H2R +  ln ln  Таким образом, потенциал хингидронного электрода определяется водородным показателем раствора (рН = -lg
Таким образом, потенциал хингидронного электрода определяется водородным показателем раствора (рН = -lg  ) и его можно использовать как индикаторный при измерениях рН среды. ) и его можно использовать как индикаторный при измерениях рН среды.
|
Величина стандартного окислительно-восстановительного потенциала характеризует свойства окислителей и восстановителей, а именно: чем выше Е0, тем более сильным окислителем являются ионы в высшей степени окисления.
Окислительно-восстановительные ( Ox - Red - ) электроды. Приведите пример Ox - Red - электрода, потенциал которого зависит от pH раствора. Запишите электродную реакцию и уравнение Нернста, назовите все используемые величины.

Уравнение Нернста:


|
из
5.00
|
Обсуждение в статье: Окислительно-восстановительные электроды: определение, примеры, электродные полуреакции. Вывод и анализ уравнения Нернста для электродов данного типа. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

