 |
Главная |
Химические свойства спиртов
|
из
5.00
|
Диссоциация спиртов на ионы происходит в незначительной степени, поэтому спирты дают нейтральную реакцию — в их присутствии не изменяется окраска лакмуса или фенолфталеина.
Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют с щелочными металлами с образованием алкоголятов (в данном примере – этилалкоголята калия):

Спирты вступают в реакции замещения с галогеноводородами:

С кислотами (органическими или неорганическими) спирты вступают в реакцию этерификации в присутствии серной кислоты с образованием сложных эфиров:
O O
// H+ //
H3C—С—OH + HO—C2H5 → H3C—C—O—C2H5 + H2O
уксусная этиловый эфир
кислота уксусной кислоты
(этилацетат)
При нагревании спирта в присутствии сильной кислоты происходит отщепление молекулы воды от двух молекул спирта в результате межмолекулярной дегидратации и образуется простой эфир (в данном примере – диэтиловый эфир):

Диэтиловый или серный эфир — хороший растворитель многих органических веществ, применяется для чистки тканей, а в медицине — при хирургических операциях, так как обладает анестезирующим действием.
Спирты вступают в реакции отщепления воды - элиминирования, или внутримолекулярной дегидратации, с образованием непредельных углеводородов. Данная реакция становится преобладающей при использовании больших количеств кислоты:

Спирты ступают в реакции окисления. Окисление – это процесс увеличения числа атомов кислорода в молекулах органических соединений и уменьшения числа атомов водорода. Первичные спирты окисляются в альдегиды, которые, в свою очередь, могут окисляться в карбоновые кислоты:
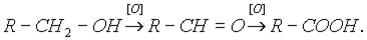
Вторичные спирты окисляются в кетоны:

Третичные спирты более устойчивы к окислению. При действии на них сильных окислителей может происходить расщепление углеродного скелета молекулы третичного спирта с образованием карбоновых кислот и кетонов с меньшим числом углеродных атомов, чем в молекуле исходного третичного спирта. Окисление обычно проводят дихроматом или перманганатом калия с серной кислотой.
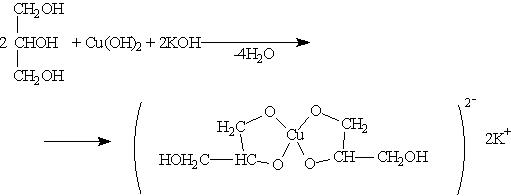
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов:
Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):

Применение спиртов:Этиленгликоль применяют:
1) в качестве антифриза; 2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу); 2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.
Альдегиды, кетоны
Органические соединения, в молекуле которых имеется карбонильная группа >С=O, называются карбонильными соединениями, или оксосоединениями. Карбонильные соединения делятся на две большие группы — альдегиды и кетоны.
Альдегиды содержат в молекуле карбонильную группу, связанную с атомом водорода, т. е. альдегидную группу — СН=O. Кетоны содержат карбонильную группу, связанную с двумя углеводородными радикалами, т. е. кетонную группу 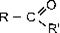 .
.
В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими, алициклическими и ароматическими.
Изомерияальдегидов связана только со строением радикалов. Изомерия кетонов связана со строением радикалов и с положением карбонильной группы в углеродной цепи.
Номенклатура. Для альдегидов часто используют тривиальные названия, соответствующие названиям кислот (с тем же числом углеродных атомов), в которые альдегиды переходят при окислении. При составлении названия альдегида указывается название соответствующего углеводорода, к которому добавляется суффикс «аль», например, метаналь Н2С=О, этаналь Н3СС(Н)=О, пропаналь Н3ССН2С(Н)=О.
CH3-CHO - ацетальдегид - этанальCH3-CH2-CHO - пропиональдегид - пропанальCH3-CH2-CH2-CHO - бутиральдегид - бутанальCH2=CH-CHO - акролеин (акрилальдегид) - пропенальС6H5-CHO - бензальдегидВ более сложных случаях углеродную цепь группы R нумеруют, начиная с карбонильного углерода, затем с помощью числовых индексов указывают положение функциональных групп и различных заместителей.

В отличие от альдегидной, кетонная группа >C=O может находиться также в середине углеводородной цепи, поэтому в простых случаях указывают названия органических групп (упоминая их в порядке увеличения) и добавляют слово «кетон»: диметилкетон CH3–CO–CH3, метилэтилкетон CH3CH2–CO–CH3. В более сложных случаях положение кетонной группы в углеводородной цепи указывают цифровым индексом, добавляя суффикс «он». Нумерацию углеводородной цепи начинают с того конца, который находится ближе к кетонной группе.

В молекуле кетона радикалы могут быть одинаковыми или разными. Поэтому кетоны, как и простые эфиры, делятся на симметричные и смешанные.
Химические свойства
Строение оксо-группы.Альдегиды характеризуются высокой реакционной способностью. Большая часть их реакций обусловлена наличием карбонильной группы. Атом углерода в карбонильной группе находится в состоянии sp2 -гибридизации и образует три σ- связи (одна из них - связь С-О), которые расположены в одной плоскости под углом 1200 друг к другу.

Схема строения карбонильной группы
Важнейшими реакциями альдегидов являются реакции нуклеофильного присоединения по двойной связи карбонильной группы.
1. Реакция с синильной кислотой. Одной из типичных реакций нуклеофильного присоединения альдегидов является присоединение синильной (циановодородной) кислоты, приводящее к образованию ά- оксинитрилов:

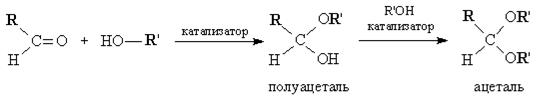
2. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали. Полуацеталями называются соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы:
3. Взаимодействие с аммиаком и аминами. Реакция взаимодействия с аммиаком и аминами идет по типу «присоединение-отщепление», на первой стадии происходит присоединение аммиака или амина, а на второй стадии происходит отщепление воды с образованием двойной связи между карбонильным атомом углерода и атомом азота аминогруппы. Таким образом, образуются соединения, называемые основаниями Шиффа – соединения, содержащие фрагмент >C=NR. Соединения, образованные присоединением аминов, называются имином, гидроксиламином – оксимом, гидразином – гидразоном.

Продукт взаимодействия формальдегида с аммиаком несколько иной – это результат циклизации трех промежуточных молекул, в результате получается каркасное соединение гексаметилентетрамин, используемое в медицине как препарат уротропин.

|
из
5.00
|
Обсуждение в статье: Химические свойства спиртов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

