 |
Главная |
В каждой окислительно – восстановительной реакции проставить степени окисления и записать полуреакции
|
из
5.00
|
Написать названия химических соединений, участвующих в реакциях.
Приложение
Элементы главной подгруппы А VII группы имеют групповое название «галогены», иначе «солеобразователи». К этим элементам относятся  – фтор,
– фтор,  – хлор,
– хлор,  – бром,
– бром, 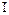 – йод,
– йод, 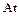 – астат.
– астат.
Электронные формулы:
 –
– 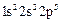 (фтор);
(фтор);
 –
–  (хлор);
(хлор);
 –
–  (бром);
(бром);
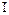 –
–  (йод);
(йод);
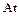 -
-  (астат).
(астат).
Все свойства элементов, определяемые электронной оболочкой атома, закономерно изменяются по периодам и группам периодической системы. В ряду элементов-аналогов электронные структуры сходны, но нетождественны.
У галогенов в их соединениях встречаются нечетные степени окисления от (-I) до (+VII), равной номеру группы. Только фтор имеет одну степень окисления (-I), так как является всегда акцептором электрона (табл. 1).
Таблица 1
Степени окисления галогенов и отвечающие им соединения

|  , ,  , ,  , , 
|

| 
|

|  , , 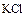
|

| 
|

|  , ,  , , 
|

|  , , 
|
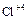
| 
|

|  , , 
|

| 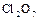 , , 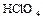 , , 
|

|  , , 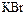
|

| 
|

|  , ,  , , 
|

|  , , 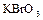
|

| 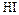 , , 
|

| 
|
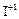
|  , , 
|
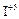
|  , ,  , , 
|

|  , ,  , , 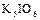
|
Вследствие большой химической активности, галогены находятся в природе только в связанном состоянии (например, в виде солей галогеноводородных кислот).
Наиболее распространены в природе хлор (0,19%) и фтор (0,03%). Основные массы хлора и брома содержатся в водах океанов, морей и соляных озер. Бром, иод и астат – рассеянные элементы, не образующие своих минералов. Фтор содержится в минералах: флюорит (плавиковый шпат)  , криолит
, криолит 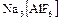 , фторапатит
, фторапатит  . Плавиковый шпат получил это название потому, что его прибавление к железным рудам приводит к образованию легкоплавких шлаков при выплавке чугуна. Флюорит – очень ценное сырье, но запасы этого минерала на исходе. Криолит («ледяной камень») богаче фтором, чем флюорит, но единственное на Земле месторождение криолита в Гренландии почти полностью исчерпано. Хлор входит в состав таких минералов, как галит
. Плавиковый шпат получил это название потому, что его прибавление к железным рудам приводит к образованию легкоплавких шлаков при выплавке чугуна. Флюорит – очень ценное сырье, но запасы этого минерала на исходе. Криолит («ледяной камень») богаче фтором, чем флюорит, но единственное на Земле месторождение криолита в Гренландии почти полностью исчерпано. Хлор входит в состав таких минералов, как галит  , сильвин
, сильвин 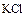 , карналлит
, карналлит  . Морская вода – практически неисчерпаемый источник получения хлора и брома. Буровые воды нефтяных месторождений – основной промышленный источник иода и брома; содержание брома здесь достигает 0,01%, а иода – 0,003%. Существуют некоторые водоросли, которые накапливают в своих тканях иод, соединения которого в малых количествах имеются в морской воде. Зола этих водорослей служит сырьем для получения иода. Астат – один из самых редких на Земле элементов: в поверхностном слое земной коры толщиной 1,6 км содержится около 70 мг астата.
. Морская вода – практически неисчерпаемый источник получения хлора и брома. Буровые воды нефтяных месторождений – основной промышленный источник иода и брома; содержание брома здесь достигает 0,01%, а иода – 0,003%. Существуют некоторые водоросли, которые накапливают в своих тканях иод, соединения которого в малых количествах имеются в морской воде. Зола этих водорослей служит сырьем для получения иода. Астат – один из самых редких на Земле элементов: в поверхностном слое земной коры толщиной 1,6 км содержится около 70 мг астата.
Все галогены обладают очень резким запахом. Вдыхание их даже в небольших количествах вызывает сильное раздражение дыхательных путей и воспаление слизистых оболочек. Более значительные количества галогенов могут вызвать тяжелое отравление.
Фтор – светло-желтый газ (Т пл. -220ºС, Т кип. -188ºС), является наиболее активным простым веществом.
Хлор, бром и иод отличаются друг от друга по агрегатному состоянию: хлор – желто-зеленый газ, более чем в 2 раза тяжелее воздуха (Т пл. -101ºС, Т кип. -34ºС), бром – тяжелая буровато-коричневая жидкость (Т пл. -7ºС, Т кип.-59ºС), а иод – твердые черно-фиолетового цвета кристаллы, плавящиеся с частичной возгонкой при 114ºС (Т кип. расплава -186ºС).
Галогены сравнительно мало растворимы в воде. Один объем воды растворяет при комнатной температуре около 2,5 объемов хлора. Растворимость брома при 20ºС составляет около 3,5 г, а растворимость иода всего 0,02 г на 100 г воды.
Фтор не может быть растворен в воде, так как энергично разлагает ее:

Значительно лучше, чем в воде, бром и иод растворяются в органических растворителях: сероуглероде, этиловом спирте, диэтиловом эфире, хлороформе, бензоле. Этим пользуются для извлечения брома и иода из водных растворов.
Свободные галогены проявляют чрезвычайно высокую химическую активность. Особенно быстро и с выделением большого количества теплоты протекают реакции соединения галогенов с металлами. Медь, олово, железо и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Подобным же образом реагируют с металлами бром и иод. Во всех этих случаях галогены демонстрируют окислительные свойства:

Фтор взаимодействует практически со всеми другими простыми веществами, кроме  ,
,  ,
,  , проявляя свойства сильнейшего окислителя. Со многими неметаллами фтор взаимодействует на холоду; реакции протекают со взрывом или с образованием пламени:
, проявляя свойства сильнейшего окислителя. Со многими неметаллами фтор взаимодействует на холоду; реакции протекают со взрывом или с образованием пламени:
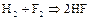 (+541,4 кДж).
(+541,4 кДж).
Химическая активность галогенов уменьшается от фтора к астату, одновременно наблюдается усиление металлических свойств. Окислительные свойства наиболее сильны у фтора, хлора и брома. Проявляются они и при взаимодействии галогенов со сложными веществами:
1. При пропускании хлора через раствор хлорида железа (II) последний окисляется в хлорид железа (III), вследствие чего раствор из бледно-зеленого становится желтым:

2. Если к желтоватому водному раствору иода добавить сероводородной воды (водный раствор  ), то жидкость обесцвечивается и становится мутной от выделившейся серы:
), то жидкость обесцвечивается и становится мутной от выделившейся серы:

Иод обладает окислительно-восстановительной двойственностью. Например, он является окислителем по отношению к  и
и  ; восстановительные свойства иод проявляет при взаимодействии с
; восстановительные свойства иод проявляет при взаимодействии с  и
и  .
.
3. При действии водного раствора брома на раствор сульфита натрия  происходит обесцвечивание раствора, так как бром окисляет сульфит до сульфата натрия, а сам восстанавливается, превращаясь в бесцветный бромоводород. Реакция протекает при участии молекул воды и выражается уравнением:
происходит обесцвечивание раствора, так как бром окисляет сульфит до сульфата натрия, а сам восстанавливается, превращаясь в бесцветный бромоводород. Реакция протекает при участии молекул воды и выражается уравнением:

Химическая активность фтора исключительно высока. Из простых веществ фтор непосредственно не реагирует только с кислородом, азотом и углеродом (в виде алмаза). Фтор очень энергично взаимодействует со сложными веществами, даже такие устойчивые, как стекло (в виде ваты):
 (+657 кДж)
(+657 кДж)
Кислородсодержащие соединения галогенов. Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее – оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисления, достигающую семи.
Кислородные соединения галогенов могут быть получены только косвенным путем.
Фторид кислорода  можно получить пропусканием фтора в охлажденный 2% раствор
можно получить пропусканием фтора в охлажденный 2% раствор 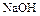 :
:

Фторид кислорода очень ядовит, проявляет сильные окислительные свойства.
Хлорноватистая кислота  образуется в процессе гидролиза хлора:
образуется в процессе гидролиза хлора:
 (-25 кДж)
(-25 кДж)
Хлорноватистая кислота – очень слабая кислота (К = 5×10-8) и очень сильный окислитель.
Если в этой реакции принимает участие щелочь, то равновесие в системе сдвигается вправо; реакция практически доходит до конца:
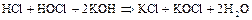
В растворе хлорноватистая кислота испытывает три различных типа превращений, которые протекают независимо друг от друга:
 (1)
(1)
 (2)
(2)
 (3)
(3)
Изменяя условия, можно добиться того, что реакция пройдет практически нацело по какому-нибудь одному направлению.
Реакция типа (3) особенно легко идет при нагревании. Поэтому, если пропускать хлор в горячий раствор гидроксида калия, то вместо  сразу получается
сразу получается  :
:

Продуктами реакции являются хлорид калия и хлорат калия  - соль хлорноватой кислоты
- соль хлорноватой кислоты  . Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
. Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
При действии концентрированной серной кислоты на  выделяется желто-бурый газ с характерным запахом – диоксид хлора
выделяется желто-бурый газ с характерным запахом – диоксид хлора  . Это очень неустойчивое соединение; при взаимодействии его с раствором щелочи медленно протекает реакция:
. Это очень неустойчивое соединение; при взаимодействии его с раствором щелочи медленно протекает реакция:

с образованием солей двух кислот – хлорноватой  и хлористой
и хлористой  . Хлористая кислота малоустойчива.
. Хлористая кислота малоустойчива.
При осторожном нагревании хлората калия без катализатора его разложение протекает в основном согласно схеме:

Действием концентрированной серной кислоты на  может быть получена свободная хлорная кислота
может быть получена свободная хлорная кислота  (бесцветная, дымящая на воздухе жидкость). Безводная
(бесцветная, дымящая на воздухе жидкость). Безводная  малоустойчива и иногда взрывается при хранении; самая сильная из известных кислот.
малоустойчива и иногда взрывается при хранении; самая сильная из известных кислот.
Характерно вытеснение более электроположительного галогена из его соединений с металлами более электроотрицательным галогеном. Например,  вытесняет другие галогены из их галогенидов, а бром – только иод из иодидов металлов:
вытесняет другие галогены из их галогенидов, а бром – только иод из иодидов металлов:  . Это свойство галогенов обусловлено значениями их стандартных электродных потенциалов (
. Это свойство галогенов обусловлено значениями их стандартных электродных потенциалов (  , В), равных для
, В), равных для  ,
,  ,
,  и
и  соответственно 2,87; 1,36; 1,09; 0,54 (для кислых водных растворов).
соответственно 2,87; 1,36; 1,09; 0,54 (для кислых водных растворов).
Причиной высокого сродства галогенов к электрону является наличие пяти электронов на атомной р-орбитали, в том числе одного неспаренного. Присоединение электрона приводит к образованию галогенидных ионов (  ,
,  ,
,  ,
,  и
и  ) с устойчивой 8-электронной оболочкой следующего за галогеном благородного газа.
) с устойчивой 8-электронной оболочкой следующего за галогеном благородного газа.
Химическая природа элемента обуславливается способностью его атома терять и приобретать электроны. Эта способность может быть количественно оценена двумя характеристиками энергией ионизации, Еи (потенциал ионизации) атома и его энергией сродства к электронуF.
Энергия ионизации - энергия, необходимая для полного удаления электрона из нейтрального газового атома (образование положительного иона) в его основном состоянии без сообщения электрону кинетической энергии. Размерность (единицы измерения) [Еи] ~ [кДж / моль] или ~ [эВ / моль] (электрон – вольт на моль).
Значение Eu всегда положительное. Например, Eu водорода H(r) = H+(r) + e-, равная +1312,1 кДж\моль, представляет собой переход с 1s –АО (E1) на АО с n=¥ c E¥ =0.
У многоэлектронных атомов различают первую (E1u), вторую (E2u), третью (E3u) и т.д. энергию ионизации по последовательному удалению электронов от ядра атома. При этом E1u< E2u < E3u , поскольку второй, третий электрон приходиться отрывать от положительно заряженного иона, заряд которого возрастает после удаления каждого электрона. Например, для лития E1u =521,1 кДж\моль, E2u =7295,4 кДж\моль,
E3u =11817,6 кДж\моль.
Наибольшим значением энергии ионизации обладают атомы благородных газов, имеющие полностью заселенный электронами энергетический уровень ns2np6. Наименьшее значение энергии ионизации обнаружено у атомов щелочных элементов, у которых на внешней ns – АО находится всего один электрон, надежно экранированный от воздействия ядра 8-электронной оболочкой предыдущего благородного газа (кроме Li).
Цель применения Еи в химии:
1. Оценка восстановительных свойств атомов (можно использовать для любых атомов).
2. Так как металлы обладают только восстановительными свойствами, то Еи можно использовать для оценки химической активности металлов. Чем меньше Еи, тем больше восстановительные свойства атомов, тем активнее металл.
Однако, Еи не является однозначной характеристикой для оценки восстановительных свойств веществ и активности металлов.
Это связано с тем, что большинство элементов находятся в связанном состоянии (образуют молекулы – F2 – либо металлические решетки или решетки другого типа). Для того, чтобы вещество вступило в реакцию, необходимо не только отрывать электроны от атомов, но и разрывать химические связи, которые зачастую очень прочны.
Несмотря на то, что Еи часто играет ведущую роль, во многих случаях реальный эффект зависит от прочности химической связи.
Изменение Еи атомов вдоль периода. Вдоль периода радиус атомов уменьшается, что приводит к увеличению прочности связи электрона с ядром → увеличение Еи слева направо (рис. 1.). Однако характер изменения Еи несколько усложняется из-за двух причин:
1) в электронной конфигурации некоторых атомов появляются новые электроны.

Рис. 1. Изменение энергии ионизации в периоде
2) электронные конфигурации с наполовину заполненными (или полностью) квантовыми ячейками наиболее устойчивы, и электроны из них труднее удалять. Это приводит к относительному увеличению энергии ионизации.
Слева направо убывают восстановительные свойства атомов (но немонотонно).
Изменение Еи в подгруппах. Сверху вниз из-за увеличения радиуса прочность связи электрона с ядром уменьшается, и Еи уменьшается. Это основная тенденция. Но так как радиус атомов изменяется немонотонно (в подгруппах p- и d-металлов – эффект вторичной периодичности), то этот эффект также проявляется в изменении Еи. В точках, где случается относительное сжатие, происходит относительное увеличение Еи (см. рис. 2, 3).
Вывод: Еи d-металлов IV и V периодов очень близки между собой, а Еи металла VI периода очень высока, значит, превышает Еи IV. В побочных подгруппах металлическая активность ослабляется.
Даже небольшое уменьшение Еи V периода по сравнению с IV не приводит к увеличению металлической активности, так как это свойство будет зависеть не только от Еи, но и от Е кристаллической решетки (которая в подгруппах сверху вниз всегда возрастает, о чем свидетельствует увеличение t° плавления сверху вниз в побочных подгруппах).

Рис. 2. Изменение энергии ионизации в подгруппе р-металлов

Рис. 3. Изменение энергии ионизации в подгруппе d-металлов
Энергия сродства к электрону (F).Определение: Энергией сродства к электрону называется энергия, выделяющаяся при присоединении электрона к атому.
[F] = ккал/моль. [F] ~ [кДж / моль] или ~ [эВ / моль].
Характеризует следующий процесс:
Э + ē→Э- F1
Э- + ē→Э2- F2
Чем прочнее связываются с атомом избыточные электроны, тем больше энергия сродства к электрону. Присоединение электронов характерно для неметаллов. Металлы их практически не присоединяют. Таким образом, F характеризует прочность связи с ядром избыточных (чужих) электронов. Обычно атом не может присоединить большого числа электронов, и максимальное их количество определяется правилом октета. Фтор может присоединить 1 электрон, кислород – 2 электрона.
Следствие: F используют для оценки окислительных свойств атомов, а в случае типичных неметаллов – для оценки химической активности. Это связано с тем, что для типичных неметаллов (Cl2, F2, Br2) характерно вступать в реакции с присоединением электронов, т.е. они являются окислителями.
Прочность связи присоединившихся электронов с ядром также зависит от размера атома: r↓, следовательно, связь прочнее, F↑. В результате, F меняется в периодической системе по тем же законам, что и Еи. Однако F применяется для характеристики меньшего числа групп, конкретно – для подгрупп типичных неметаллов (VI, VII, V главной подгруппы).
Электроотрицательность (χ) характеризует способность атомов притягивать к себе электронную плотность ковалентной связи в соединении.
Тогда атом, обладающий большей электроотрицательностью и притягивающий электронную плотность в соединении, называется электроотрицательным, а другой – электроположительным.
Впервые понятие электроотрицательности было введено химиком Полингом. Он ввел 4х-балльную шкалу электроотрицательности, максимальное значение 4 имеет фтор. Однако по шкале Полинга χ лишена физического смысла. В настоящее время существуют различные шкалы измерения χ, но широкое применение нашла шкала χ по Малликену. Здесь χ имеет четкий физический смысл:
χ =1/2 (Еи + F)
Электроотрицательность элементов связана, с одной стороны, со склонностью свободного атома удерживать свои внешние электроны (Еи атома), а с другой стороны, со склонностью атома притягивать дополнительные электроны (сродство атома к электрону). Поэтому электроотрицательность часто рассматривается как функция этих двух видов энергии.
Следовательно, если известно, как меняется в периодической системе Еи и F, то можно определить характер изменения χ.
В периоде слева направо F↑ Eи↑, следовательно, χ ↑ (т.к. радиус уменьшается). В подгруппах сверху вниз r↑, следовательно, χ↓ (основная тенденция). Как и в характере изменения Еи в подгруппах по тем же законам наблюдается эффект вторичной периодичности.
Понятие электроотрицательности является условным. Оно позволяет оценить способность атома данного элемента оттягивать на себя электронную плотность по сравнению с атомами других элементов в соединении. Имеется около 20 шкал электроотрицательности. Значения электроотрицательности разных шкал различаются, но относительное расположение элементов в ряду электроотрицательностей примерно одинаково. Наибольшее распространение в России имеет шкала Полинга(табл. 2).
Таблица 2
Электроотрицательности s- и p-элементов в их стабильных степенях окисления.
| I A | II A | III A | IV A | V A | VI A | VII A |
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 |
| Na 0,9 | Mg 1,3 | Al 1,5 | Si 1,8 | P 2,2 | S 2,6 | Cl 3,16 |
| K 0,8 | Ca 1,0 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | Jn 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | J 2,5 |
| Cs 0,7 | Ba 0,9 | Tl (III) 1,8 | Pb (II) 1,6 | Bi 1,9 | Po 2,0 | At 2,2 |
|
из
5.00
|
Обсуждение в статье: В каждой окислительно – восстановительной реакции проставить степени окисления и записать полуреакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

