 |
Главная |
Изучить строение молекул. 1.1. Зарисовать структурную и геометрическую формулы молекулы оксида фосфора (III)
|
из
5.00
|
1.1. Зарисовать структурную и геометрическую формулы молекулы оксида фосфора (III)  .
.
1.2. Зарисовать схему электронного строения атомов азота и фосфора.
1.3. Зарисовать структурную и геометрическую формулы молекулы белого фосфора  .
.
1.4. Зарисовать структурную и геометрическую формулы молекулы аммиака  .
.
1.5. Зарисовать структурную и геометрическую формулы молекулы азота  .
.
1.6. Зарисовать структурную и геометрическую формулы молекулы фосфина  .
.
1.7. Зарисовать структурную и геометрическую формулы молекулы азотистой кислоты  .
.
1.8. Зарисовать структурную и геометрическую формулы молекулы азотной кислоты  .
.
1.9. Зарисовать структурную и геометрическую формулы молекулы фосфорной кислоты  .
.
1.10. Зарисовать структурную и геометрическую формулы молекулы фосфористой кислоты  .
.
1.11. Зарисовать структурную и геометрическую формулы молекулы оксида фосфора (V)  .
.
1.12. Зарисовать структурную и геометрическую формулы молекул оксидов азота: оксид азота (I) –  ; оксид азота (II) –
; оксид азота (II) –  ; оксид азота (IV) –
; оксид азота (IV) –  .
.
2. Наблюдать опыты и написать уравнения следующих реакций:
2.1. Взаимодействие нитрата серебра с фосфатом натрия. Образуется фосфат серебра.
2.2. Разложение бихромата аммония.
2.3. Взаимодействие фосфора с концентрированной азотной кислотой.
2.4. Разложение хлорида аммония при нагревании. Образуется аммиак и хлороводород.
2.5. Разложение нитрата аммония.
2.6. Взаимодействие оксида серебра с аммиаком.
2.7. Взаимодействие амальгамы натрия с хлоридом аммония.
2.8. Взаимодействие нитрата натрия с соляной кислотой. Образуется бурый газ оксида азота (IV).
2.9. Взаимодействие меди с азотной кислотой. Выделяется оксид азота (IV), при нагревании реакция ускоряется.
2.10. Разложение нитрата меди при нагревании. Образуется оксид азота (IV) бурого цвета и оксид меди (II) черного цвета.
2.11. Разложение азотной кислоты при нагревании. Образуется оксид азота (IV)  .
.
2.12. Взаимодействие свинца с азотной кислотой. При нагревании выделяется оксид азота (I)  . Без нагрева реакция останавливается.
. Без нагрева реакция останавливается.
2.13. Взаимодействие оксида фосфора (V) с водой.
2.14. Окисление аммиака.
В каждой окислительно-восстановительной реакции проставить степени окисления и записать полуреакции.
Написать названия соединений в химических реакциях.
Приложение
К элементам V группы главной подгруппы А относятся:  – азот,
– азот,  – фосфор,
– фосфор,  – мышьяк,
– мышьяк,  – сурьма,
– сурьма,  – висмут.
– висмут.
Электронные формулы:
 (азот);
(азот);
 (фосфор);
(фосфор);
 (мышьяк);
(мышьяк);
 (сурьма);
(сурьма);
 (висмут).
(висмут).
Азот и фосфор относятся к типическим элементам, а мышьяк, сурьму и висмут объединяют в подгруппу мышьяка. Размеры атомов и ионов увеличиваются в группе сверху вниз по вертикали от  к
к  , а энергии ионизации уменьшаются. Этим обусловлено ослабление признаков неметаллических элементов.
, а энергии ионизации уменьшаются. Этим обусловлено ослабление признаков неметаллических элементов.
Азот – типичный неметаллический элемент, по электроотрицательности уступает лишь фтору и кислороду.
Элементы подгруппы мышьяка имеют неметаллические и металлические модификации. Устойчивые в обычных условиях модификации – серый мышьяк, серая сурьма, висмут – имеют металлический вид, электрическую проводимость, хрупкие из-за солистой структуры (типа черного фосфора).
Азот занимает 5 место по распространённости химических элементов в Космосе. Основная масса его входит в состав атмосферы в виде простого вещества. Азот входит в состав белковых тел всех растительных и животных организмов, обнаружен в газовых туманностях и солнечной атмосфере, на Уране и Нептуне. Степени окисления азота в соединениях -3; -1; +1; +3; +5, а также -2, +2 и +4. В обычных условиях азот непосредственно взаимодействует лишь с литием с образованием  . При активации молекул
. При активации молекул  (нагревании, действии электроразряда или ионизирующего излучения) азот выступает как окислитель, а при взаимодействии с фтором и кислородом как восстановитель. В промышленности азот получают фракционированной перегонкой жидкого воздуха, в лаборатории – термическим разложением соединений, чаще всего нитрата аммиака
(нагревании, действии электроразряда или ионизирующего излучения) азот выступает как окислитель, а при взаимодействии с фтором и кислородом как восстановитель. В промышленности азот получают фракционированной перегонкой жидкого воздуха, в лаборатории – термическим разложением соединений, чаще всего нитрата аммиака  :
:

Основная масса получаемого азота используется для синтеза аммиака, большая часть которого идет на производство азотной кислоты и других азотосодержащих веществ. Кроме того, азот применяют для создания инертной атмосферы в химических производствах, электрических лампах, при перекачке горючих жидкостей и т.п. При высоких температурах азот окисляет многие металлы и неметаллы, образуя нитриды:
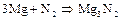 – нитрид магния
– нитрид магния
 – нитрид водорода (или
– нитрид водорода (или  – аммиак)
– аммиак)
Из нитридов наибольшее практическое значение имеет аммиак. Среди водородных соединений p–элементов V группы аммиак занимает такое же особое положение, как вода среди водородных соединений p–элементов VI группы. В химическом отношении аммиак довольно активен; он вступает во взаимодействие со многими веществами. Азот в аммиаке имеет самую низкую степень окисления
(-3). Поэтому аммиак обладает только восстановительными свойствами.


| восстановитель (окисление); | ||

| окислитель (восстановление); |

В зависимости от условий окисления аммиака может протекать по реакции:


| восстановитель (окисление); | ||

| окислитель (восстановление); |

Атом азота в молекуле аммиака связан тремя ковалентными связями с атомами водорода и сохраняет при этом одну неподелённую электронную пару:
 Согласно теории валентных связей это отвечает
Согласно теории валентных связей это отвечает  – гибридизации валентных орбиталей атома азота. Из четырёх
– гибридизации валентных орбиталей атома азота. Из четырёх  – гибридных орбиталей азота три участвуют в образовании трёх s - связей
– гибридных орбиталей азота три участвуют в образовании трёх s - связей  –
–  , а четвертую орбиталь занимает несвязывающая электронная пара. Поскольку несвязывающее электронное облако отчётливо ориентировано в пространстве, молекула
, а четвертую орбиталь занимает несвязывающая электронная пара. Поскольку несвязывающее электронное облако отчётливо ориентировано в пространстве, молекула  – резко выраженный донор электронной пары и обладает высокой полярностью (m = 0,49×10-29 Кл×м). Выступая в качестве донора электронной пары, аммиак способен вступать в реакции присоединения с образованием комплексных соединений, ионов аммония
– резко выраженный донор электронной пары и обладает высокой полярностью (m = 0,49×10-29 Кл×м). Выступая в качестве донора электронной пары, аммиак способен вступать в реакции присоединения с образованием комплексных соединений, ионов аммония  , комплексных ионов:
, комплексных ионов:



Аммиак очень хорошо растворяется в воде, при этом имеет место ионизация – появляются ионы аммония  и ионы
и ионы 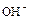 . Среда раствора щелочная. При взаимодействии ионов
. Среда раствора щелочная. При взаимодействии ионов  и
и 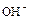 вновь образуются молекулы
вновь образуются молекулы  и
и  , между которыми возникает водородная связь. Ионное соединение
, между которыми возникает водородная связь. Ионное соединение  (гидроксид аммония) не существует. Но по традиции водный раствор аммиака обозначает формулой
(гидроксид аммония) не существует. Но по традиции водный раствор аммиака обозначает формулой  .
.
Соли аммония термически неустойчивы. При нагревании они разлагаются обратимо или необратимо в зависимости от окислительных свойств аниона. Если анион не является окислителем или в слабой степени проявляет окислительные свойства, процесс распада обратим:
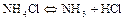
Если анион проявляет резко выраженные окислительные свойства, соли распадаются необратимо:

Азот образует с кислородом ряд оксидов: оксид азота (I)  (закись азота); оксид азота (II)
(закись азота); оксид азота (II)  , оксид азота (IV)
, оксид азота (IV)  (диоксид ли двуокись); оксид азота (III)
(диоксид ли двуокись); оксид азота (III)  (азотистый ангидрид).
(азотистый ангидрид).
Наибольший интерес представляет  . При растворении в воде вступает в реакцию с
. При растворении в воде вступает в реакцию с  , образуют азотную
, образуют азотную  и азотистую
и азотистую  кислоты.
кислоты.
Азотистая кислота нестойка и быстро разлагается:

Следовательно,

 в присутствии кислорода воздуха окисляется до
в присутствии кислорода воздуха окисляется до  и, в конечном итоге, полностью переходит в
и, в конечном итоге, полностью переходит в  :
:

Диоксид азота – очень энергичный окислитель. Многие вещества могут гореть в атмосфере  , отнимая от него кислород. На этом свойстве основан нитрозный метод получения серной кислоты:
, отнимая от него кислород. На этом свойстве основан нитрозный метод получения серной кислоты:

В атмосфере  горят уголь, сера, фосфор. Диоксид азота применяют как нитрующий агент, например, для получения безводных нитратов.
горят уголь, сера, фосфор. Диоксид азота применяют как нитрующий агент, например, для получения безводных нитратов.
Азотистая кислота обладает сильно выраженными окислительными свойствами:


Она разрушает животные и растительные ткани, окисляет почти все металлы и неметаллы. Образование тех или продуктов взаимодействия зависит от концентрации  , активности простого вещества и температуры. Достаточно разбавленная кислота восстанавливается до
, активности простого вещества и температуры. Достаточно разбавленная кислота восстанавливается до  , с повышением её концентрации более характерно образование
, с повышением её концентрации более характерно образование  ; концентрированная
; концентрированная  восстанавливается до
восстанавливается до  :
:



Фосфор вследствие легкой окисляемости в свободном состоянии в природе не встречается. Из природных соединений фосфора самым важным является ортофосфат кальция  , который в виде минерала фосфорита иногда образует большие залежи. Минерал апатит содержит, кроме
, который в виде минерала фосфорита иногда образует большие залежи. Минерал апатит содержит, кроме  , еще
, еще  или
или 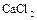 . Для получения фосфора природный фосфорит или апатит измельчают, смешивают с песком и углем и накаливают в печах с помощью электрического тока без доступа воздуха:
. Для получения фосфора природный фосфорит или апатит измельчают, смешивают с песком и углем и накаливают в печах с помощью электрического тока без доступа воздуха:


Фосфор выделяется в виде паров, которые конденсируются в приемнике под водой.
Фосфор образует несколько аллотропных видоизменений: белый фосфор, красный и черный.
Одна из сфер применения фосфора – получение некоторых полупроводников: фосфида галлия 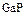 , фосфида индия
, фосфида индия  . В состав других полупроводников он вводится в очень небольших количествах в качестве необходимой добавки.
. В состав других полупроводников он вводится в очень небольших количествах в качестве необходимой добавки.
Оксид фосфора (III), или фосфористый ангидрид,  получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при 23,8ºС. При действии холодной воды
получается при медленном окислении фосфора или когда фосфор сгорает при недостаточном доступе кислорода. Это белые кристаллы, плавящиеся при 23,8ºС. При действии холодной воды  медленно взаимодействует с ней, образуя фосфористую кислоту
медленно взаимодействует с ней, образуя фосфористую кислоту  . Оксид и кислота обладают сильно выраженными восстановительными свойствами.
. Оксид и кислота обладают сильно выраженными восстановительными свойствами.
Оксид фосфора (V), или фосфорный ангидрид,  образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы; жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. Оксиду фосфора (V) отвечает несколько кислот. Важнейшая из них – это ортофосфорная кислота
образуется при горении фосфора на воздухе или в кислороде в виде белой объемистой снегообразной массы; жадно соединяется с водой и потому применяется как очень сильное водоотнимающее средство. Оксиду фосфора (V) отвечает несколько кислот. Важнейшая из них – это ортофосфорная кислота  . Она образует бесцветные прозрачные кристаллы, плавящиеся при 42,35ºС. В воде она растворяется очень хорошо.
. Она образует бесцветные прозрачные кристаллы, плавящиеся при 42,35ºС. В воде она растворяется очень хорошо.
Ортофосфорная кислота не принадлежит к числу сильных кислот. Константы ее диссоциации равны:  ,
,  ,
,  . Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке:
. Будучи трехосновной, она образует три ряда солей: средние и кислые с одним или с двумя атомами водорода в кислотном остатке:
 ;
;  - трехзамещенные, или средние фосфаты
- трехзамещенные, или средние фосфаты
 ;
;  - двухзамещенные фосфаты, или гидрофосфаты
- двухзамещенные фосфаты, или гидрофосфаты
 ;
;  - однозамещенные фосфаты, или дигидрофосфаты.
- однозамещенные фосфаты, или дигидрофосфаты.
В лаборатории фосфорную кислоту можно получать окислением фосфора 30%-ной  . Реакция протекает согласно уравнению:
. Реакция протекает согласно уравнению:

В промышленности фосфорную кислоту получают двумя методами: экстракционным и термическим. В основе экстракционного метода лежит обработка природных фосфатов серной кислотой:

Образующуюся фосфорную кислоту отфильтровывают от сульфата кальция и концентрируют выпариванием. Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием и растворением образующегося фосфорного ангидрида в воде. Получаемая по этому методу термическая фосфорная кислота отличается более высокой чистотой и повышенной концентрацией.
|
из
5.00
|
Обсуждение в статье: Изучить строение молекул. 1.1. Зарисовать структурную и геометрическую формулы молекулы оксида фосфора (III) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

