 |
Главная |
Стереохимические номенклатуры
|
из
5.00
|
Глава 6
| Изомерия |
Общие положения
В первой половине XIX в. был обнаружен ряд соединений с одинаковой брутто-формулой, но с разными физическими и химическими свойствами. Такие вещества назвали изомерами. Только теория строения органических соединений А. Бутлерова, по одному из положений которой свойства органических веществ определяются не только природой, составляющих их атомов, и их количеством, но и химическим строением, позволила объяснить существование изомеров. Более того, вскоре были получены все три теоретически возможных изомера пентана, структуру которых предсказал А. Бутлеров.
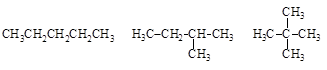
пентан изопентан неопентан
Ø Изомеры – вещества с одинаковым количественным и качественным составом, но различающиеся по строению и, соответственно, по своим свойствам.
Во второй половине XIX в. химики, изучая оптические свойства органических соединений с помощью поляриметра, выявили изомерные вещества с одинаковым химическим строением, одинаковыми физическими константами, но различающиеся своим отношением к лучу плоскополяризованного света. Например, выделенная из мышц молочная кислота СН3СН(ОН)СООН (часто называемая мясомолочной) вращала луч плоскополяризованного света вправо, молочная кислота того же состава, но полученная при сбраживании лактозы некоторыми бактериями, была левовращающей, а молочная кислота, образующаяся при молочнокислом брожении молока, квашении капусты или синтетическим способом, не проявляла оптической активности.
Оказалось, что право- и левовращающие молочные кислоты, которые можно назвать оптическими изомерами или оптическими антиподами, отличаются пространственной структурой, т.е. различным расположением атомов в пространстве. Оптически неактивная молочная кислота представляла собой смесь равных количеств оптических изомеров, называемую рацемической смесью или рацематом. Возможность существования таких изомеров удалось объяснить с помощью теории тетраэдрического строения атома углерода (Я. Вант-Гофф[1], Ж. Ле Бель[2], 1874 г.), которая легла в основу представлений о пространственном строении органических соединений.
· Поляриметр. Пропускание луча обычного света, представляющего собой электромагнитную волну с хаотически направленными колебаниями, через призму Николя, изготовленную из кристалла исландского шпата, приводит к образованию плоскополяризовонного луча света, в котором колебания осуществляются в одной плоскости. Оптически активные соединения способны отклонять плоскость луча плоскополяризовонного света вправо или влево. Определить величину угла можно с помощью прибора – поляриметра.

Рис. 6.1. Принципиальная схема поляриметра
Основными частями поляриметра являются источник света (на схеме обозначен - 1) с определенной длинной волны (обычно 589 нм, что соответствует D-линии спектра натрия), поляризатор (2) – призма Николя, в которой свет поляризуется, кювета с анализируемым веществом (3) и вторая призма Николя (4), играющая роль анализатора. При прохождении через оптически активное вещество луч плоскополяризовонного света отклоняется на определенный угол (a), который можно измерить, повернув призму-анализатор на тот же угол, что обеспечит совпадение оптических осей призмы-поляризатора и призмы-анализатора.
· Удельное и молярное вращение. На величину угла a влияет ряд факторов, в том числе, длина волны света, температура, толщина слоя анализируемого вещества, а при измерении оптической активности растворов веществ – еще концентрация и растворитель. Поэтому в качестве физической характеристики вещества используют не само значение угла a, а расчетное значение удельного вращения [a], которое определяется по формуле
[a] =  ,
,
где a – значение угла вращения в град; l – толщина слоя жидкости в кювете в дм; с – концентрация раствора в г/100 мл.
При записи удельного вращения верхним индексом указывается температура (обычно 15-25 °С), а нижним – длина волны пропускаемого света (в случае D-линии спектра натрия ставится индекс). Концентрацию (г/100 мл) и растворитель приводят после значения удельного вращения. Например, для D-винной кислоты [a]  +2,6° (с 10; метанол).
+2,6° (с 10; метанол).
Так как в значение удельного вращения включена массовая характеристика концентрации, то ее нельзя применять, например, для сравнения оптической активности ряда соединений с различной молекулярной массой. В этих случаях используют молекулярное вращение [М], которое рассчитывается по формуле
[М] =  .
.
6.1.1. Химическая структура, конфигурация, конформация
В настоящее время для описания строения органического соединения используются три основных понятия:
Ø Химическая структура (конституция) – порядок соединения атомов и типы связей в молекуле.
При упрощенной записи структур органических соединений химические связи обозначают прямыми линиями, подразумевая, что атомы углерода находятся в углах, образованных этими линиями.

химическая структура 1,4-диметилциклогексана
Ø Конфигурация –взаимное расположение в пространстве атомов и групп атомов, составляющих молекулу, без учета изменений, связанных с вращением вокруг одинарных связей.
Например, в молекуле 1,4-диметилциклогексана метильные группы могут находиться по одну сторону от плоскости цикла или – по разные.

цис- и транс-конфигурации 1,4-диметилциклогексана
Ø Конформация – пространственное расположении атомов и групп атомов молекулы определенной конфигурации, возникающее в результате поворота вокруг одинарной связи.
Например, в молекуле транс-1,4-диметилциклогексана атомы углерода цикла находятся не в плоскости, а образуют пространственную структуру, называемую «кресло».

конформации «кресло» для транс-1,4-диметилциклогексана
6.1.2. Изображение пространственного строения молекул
Для изображения пространственного строения молекул на плоскости используют ряд стереохимических и проекционных формул.
v Стереохимические формулы. Пространственное расположение заместителей у атомов углерода в sp3- и sp2-гибридизации (тетраэдрический и тригональный атомы углерода) можно показать с помощью клиновидных линий. Обычно закрашенный клин обозначает расположение заместителя перед плоскостью рисунка, а неокрашенный или заштрихованный клин – нахождение за плоскостью. Обычными линиями показывают связи находящиеся в плоскости рисунка.
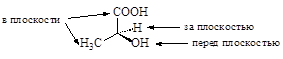
Некоторыми авторами удаление заместителя за плоскость дополнительно подчеркивается направлением острия клина к заместителю. Часто в таких формулах центральный тетраэдрический атом углерода не указывается.

стереохимические формулы молочной кислоты
v Перспективные формулы. Они удобны для показа взаимного расположения заместителей у двух соседних атомов углерода. В таких формулах связь, соединяющая эти атомы углерода, удлинена.

перспективные формулы этана и бутана
v Проекционные формулы Фишера. Для удобства работы с пространственными формулами молекул, в состав которых входит асимметрический атом углерода, Э. Фишер[3] предложил использовать плоскостные проекции (проекция Фишера).
Ø Асимметрический атом углерода – атом углерода, имеющий четыре различных заместителя.
§ В правильно расположенной проекции Фишера:
а) асимметрический атом углерода обозначается пересечением взаимно перпендикулярных линий;
б) заместители, расположенные на горизонтальной линии, в пространстве находятся над плоскостью, а на вертикальной – под плоскостью;
в) наиболее окисленный атом углерода находится сверху;
г) наиболее длинная углеродная цепь представлена вертикально.

формулы молочной кислоты:
стереохимическая проекция Фишера
В настоящее время применяются и модернизированные изображения проекций Фишера, в которых используются клиновидное обозначение направления связей.
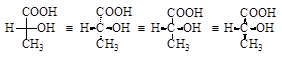
· Правила работы с проекциями Фишера:
1. Разрешено разворачивать проекцию в плоскости без изменения конфигурации на 180°.

Например, в полученной выше проекции Фишера наиболее окисленный атом углерода находится внизу. Поворот в плоскости на 180° приводит к правильному виду проекции.
2. Запрещены повороты на 90° и 270°.
3. Четное число перестановок заместителей не изменяет конфигурацию молекулы.

В приведенном примере в первоначально полученной проекции наиболее длинная углеродная цепь не расположена вертикально. Две перестановки заместителей привели к нормальному виду проекции Фишера без изменения конфигурации.
v Проекция Ньюмена[4] обычно используют для рассмотрения конформаций молекулы. Такие проекции наиболее удобны для показа расположения в пространстве заместителей двух соседних углеродных атомов. Получаются они при проецировании перспективных формул молекул на плоскость перпендикулярную рассматриваемой С-С связи. Ближний атом углерода изображают точкой, дальний – кругом.

Стереохимические номенклатуры
Первоначально для обозначения правовращающих и левовращающих изомеров использовали, соответственно, обозначения (+) или d (от латинского dextro – право) и (-) или l (от латинского laevo – лево). В свою очередь рацемат обозначался (±) или dl.
Однако такой способ наименования не имел дальнейшей перспективы. Во-первых, знак оптического вращения является физической характеристикой вещества, зависящей от длины волны света, концентрации, растворителя и других факторов. Например, (-)-яблочная кислота в водных растворах с концентрацией 8,4% имеет [a]D –2,3°, а при концентрациях 34% и 70%, соответственно, [a]D 0° и [a]D +3,3°. Также одно и то же соединение в разных растворителях может быть как лево, так и правовращающим.
Во-вторых, и это более важно, знак вращения не дает нам представления о пространственном строении соединения. Для ряда производных с одинаковой конфигурацией асимметрического центра могут быть различными знаки оптического вращения.

[a]D +2,6° (Н2О) [a]D -8,25° [a]D -75,47° [a]578 +91,8°
Все это обусловило разработку номенклатурных систем, позволяющих обозначить конфигурацию молекулы. Разберем основные виды стереохимических номенклатур, используемых в настоящее время.
v DL-номенклатура.Для обозначения конфигурации молекул Э. Фишером была предложена DL-номенклатура. По которой для определения конфигурации соединения его пространственную структуру необходимо сравнить со структурой стандартного вещества. В качестве такого стандарта в 1906 г. М. Розановым был предложен (+)-глицериновый альдегид, которому была приписана конфигурация, обозначаемая D. Соответственно, конфигурация его зеркального (-)-изомера обозначается как L.
Если некоторое соединение может быть получено из глицеринового альдегида химическими реакциями, не затрагивающими асимметрический атом углерода, то его конфигурация имеет то же обозначение, что и у стандарта. Например, последовательное окисление альдегидной функции и восстановление первичного гидроксила (+)-D-глицеринового альдегида приводит к D-молочной кислоте, которая является левовращающей.

(+)-D-глицериновый альдегид (-)-D-молочная кислота
Таким образом, определение конфигурации нового соединение проводилось путем его химического преобразование в соединение с известной конфигурацией. Установленную данным способом конфигурацию называют относительной. С появлением рентгеноструктурного метода анализа для большого числа органических соединений была определена абсолютная конфигурация – реальное расположение атомов в пространстве. В частности была подтверждена конфигурация D-винной кислоты, первоначально установленная относительно D-глицеринового альдегида, что в свою очередь подтвердило правильность пространственного строения, предложенного М. Розановым для этого стандарта.
В настоящее время DL-номенклатура применяется для построения названий углеводов, гидрокси- и аминокислот. Для других классов органических веществ используют RS-номенклатуру.
v RS-номенклатура.Р. Кан, К. Ингольд[5] и В. Прелог[6] предложили новую универсальную номенклатуру для обозначения конфигурации асимметрических центров. Для определения конфигурации необходимо:
1) установить старшинство атомов, окружающих асимметрический атом углерода.
§ Старшинство определяется порядковым номером элемента в Периодической системе. Чем больше порядковый номер элемента, тем старше атом. Ниже приведены примеры расстановки старшинства атомов.

§ Для одинаковых соседних атомов сравнивают старшинство присоединенных к ним атомов и т.д. Например, в структуре (3) атом углерода гидроксиметильной группы (одна связь на атом кислорода и две на атомы водорода) старше атома углерода этильного радикала (одна связь на атом углерода и две на атомы водорода), который старше атома углерода метильной группы (три связи на атомы водорода).

§ Кратные связи рассматривают как соответствующее количество одинарных связей (С=О = 2 С-О). Атом углерода в ароматическом цикле приравнивают к трем С-С связям. Поэтому в соединении (4) атом углерода карбоксильной группы (три связи на атомы кислорода) старше атома углерода карбонильной группы (две связи на атомы кислорода и одна на атом водорода), который в свою очередь старше атома углерода гидроксиметильной группы (одна связь на атом кислорода и две на атомы водорода).
2) Молекулу располагают в пространстве так, чтобы заместитель с наименьшим номером был заслонен от наблюдателя асимметрическим атомом.
 или
или

3) При уменьшении старшинства трех наблюдаемых заместителей по часовой стрелке изомер обозначается буквой R (rectus - правый), а если против часовой стрелки - S (sinister - левый).
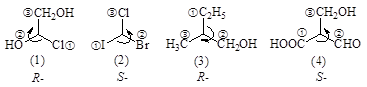
Соединение (2) по DL-номенклатуре однозначно назвать невозможно.
§ Возможно установление конфигурации по RS-номенклатуре и для проекций Фишера. После определения старшинства заместителей проекцию необходимо преобразовать таким образом, чтобы младший заместитель находился на вертикальной линии. В случае уменьшения старшинства трех оставшихся заместителей по часовой стрелке изомер имеет R-конфигурацию, в противном случае – S-конфигурацию.

v цис-,транс- и E,Z-Номенклатуры.Традиционно для геометрических изомеров расположение заместителей у связи С=С обозначают с помощью префиксов цис- (подобные заместители по одну сторону от двойной связи) и транс- (подобные заместители по разные стороны).

цис-пентен-2 транс-пентен-2
Однако такой способ описания конфигурации приемлем только для относительно простых соединений. В более сложных случаях используют E,Z-номенклатуру.
Конфигурация двойной связи по этой номенклатуре определяется следующим образом.
1) Устанавливается старшинство атомов, связанных с каждым из атомов углерода, соединенных двойной связью. Старшинство, как и в случае RS–номенклатуры, определяется по порядковому номеру соответствующего элемента в Периодической таблице. Чем больше порядковый номер элемента, тем он старше. У одинаковых атомов старшинство определяют по старшинству атомов, с которыми они связаны.
2) Оценивается взаимное положение старших атомов. Если они расположены по одну сторону плоскости двойной связи, то это Z-изомер (от нем. zusammen – вместе), а если по разные – Е-изомер (от нем. entgegen – напротив).
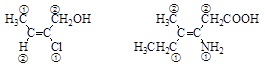
| (Е)-2-хлорбутен-2-ол-1 | (Z)-3-амино-4-метилгексен-3-овая кислота |
|
из
5.00
|
Обсуждение в статье: Стереохимические номенклатуры |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

