 |
Главная |
ЭНЕРГИЯ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. ВНУТРЕННЯЯ ЭНЕРГТЯ
|
из
5.00
|
Бибиков Д.Н.
Вещество. Системы частиц.
Учебное пособие
Нижний Новгород 2015
Рекомендовано к изданию редакционно-издательским советом Лицея 180
Рецензенты:
М.А. Урутина , учитель высшей категории МБОУ СОШ №62 кандидат педагогических наук
Е.В. Корчагин, заслуженный учитель России
Л.А. Новожилова,учитель высшей квалификационной категории МАОУ лицей №180
Вещество. Системы частиц. : учеб. пособие / Д.Н. Бибиков. Н.Новгород : МАОУ Лицей 180, 2014. – 142 с.
Введение новых программ по физике, организация факультативных курсов, наличие школ с углублённым изучением физики, вызвали потребность в пособиях, где основы физики излагались бы значительно шире и глубже, чем это сделано в стандартном учебнике.
Данное учебное пособие посвящено разделу физики «Молекулярная физика и термодинамика», в котором излагаются основы физики на более современной основе, чем это обычно принято.
Учебное пособие содержит изложение теоретических и методологических основ физических явлений на макро и микроуровне. В нем представлены цели, задачи и основные подходы к решению задач образования на основе Федерального закона Российской Федерации от 29 декабря 2012 г. N 273-ФЗ "Об образовании в Российской Федерации".
Учебное пособие предназначено для учащихся, обучающихся по программам углублённого изучения физики и математики. Оно может быть полезно для преподавателей физики школ, лицеев, колледжей и студентам вузов.
© Бибиков Д.Н.
Основные положения молекулярно- кинетической теории. Атомы и молекулы. Массы и размеры молекул.
Вещество
 Основными понятиями МКТ являются:
Основными понятиями МКТ являются:
1. Все тела состоят из молекул (атомов)
2. Молекулы движутся.
3. Молекулы взаимодействуют.
 Установлено: все макротела состоят из молекул (атомов). Доказательством служит наблюдение молекул в электронный микроскоп, косвенным доказательством является броуновское движение. Броуновское движение – это хаотическое движение микрочастиц под ударами молекул. Молекула - мельчайшая частица вещества, проявляющая химические свойства данного вещества. Атомы химических свойств могут и не проявлять, например молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода. Атомы мельчайшие частицы химических элементов. Молекулы и атомы можно наблюдать в электронный микроскоп. Размеры атома очень малы. Их диаметр порядка 10-10 м. Молекулы простых веществ так же, как и атомы, очень малы. Систематизацию атомов провёл выдающийся русский учёный Д.И. Менделеев. Каждый элемент имеет своё название и символ. Около символа пишется порядковый номер его в периодической таблице Менделеева и атомная масса, называемая массовым числом, выраженная в углеродных единицах, например азот - , кислород - . Из химии известен закон постоянных отношений: «При образовании любого количества какого-либо химического соединения массы соединяющихся веществ, всегда находятся в определённом соотношении». Например, при образовании воды из водорода и кислорода массы реагирующих веществ, всегда относятся как 1:8. Зная, что молекула воды состоит из двух атомов водорода и одного атома кислорода можно заключить, что масса атома кислорода в 16 раз больше массы атома водорода. На этом законе основано введение относительной атомной массы и относительной молекулярной массы. Число, показывающее, во сколько раз масса атома (молекулы) больше 1/12 массы атома углерода, называется относительной атомной (молекулярной) массой данного вещества. Жан Батист Перрен посмотрел на броуновское движение сверху. Он сравнил зависимость концентрации броуновских частиц от высоты с зависимостью от высоты концентрации молекул водорода. Кривые имеют одинаковый вид. Разница только в том, что в воздушной атмосфере концентрация изменяется вдвое при изменении высоты H на 5 км, а в атмосфере броуновских частиц при изменении h всего на 30 мкм. Перрен проводил опыты с частицами различных размеров и масс и установил, что изменение высоты h, при котором концентрация частиц уменьшается вдвое, обратно пропорционально массе частиц. Исходя из современных знаний можно вывести это чисто математически.
Установлено: все макротела состоят из молекул (атомов). Доказательством служит наблюдение молекул в электронный микроскоп, косвенным доказательством является броуновское движение. Броуновское движение – это хаотическое движение микрочастиц под ударами молекул. Молекула - мельчайшая частица вещества, проявляющая химические свойства данного вещества. Атомы химических свойств могут и не проявлять, например молекула воды Н2О состоит из двух атомов водорода и одного атома кислорода. Атомы мельчайшие частицы химических элементов. Молекулы и атомы можно наблюдать в электронный микроскоп. Размеры атома очень малы. Их диаметр порядка 10-10 м. Молекулы простых веществ так же, как и атомы, очень малы. Систематизацию атомов провёл выдающийся русский учёный Д.И. Менделеев. Каждый элемент имеет своё название и символ. Около символа пишется порядковый номер его в периодической таблице Менделеева и атомная масса, называемая массовым числом, выраженная в углеродных единицах, например азот - , кислород - . Из химии известен закон постоянных отношений: «При образовании любого количества какого-либо химического соединения массы соединяющихся веществ, всегда находятся в определённом соотношении». Например, при образовании воды из водорода и кислорода массы реагирующих веществ, всегда относятся как 1:8. Зная, что молекула воды состоит из двух атомов водорода и одного атома кислорода можно заключить, что масса атома кислорода в 16 раз больше массы атома водорода. На этом законе основано введение относительной атомной массы и относительной молекулярной массы. Число, показывающее, во сколько раз масса атома (молекулы) больше 1/12 массы атома углерода, называется относительной атомной (молекулярной) массой данного вещества. Жан Батист Перрен посмотрел на броуновское движение сверху. Он сравнил зависимость концентрации броуновских частиц от высоты с зависимостью от высоты концентрации молекул водорода. Кривые имеют одинаковый вид. Разница только в том, что в воздушной атмосфере концентрация изменяется вдвое при изменении высоты H на 5 км, а в атмосфере броуновских частиц при изменении h всего на 30 мкм. Перрен проводил опыты с частицами различных размеров и масс и установил, что изменение высоты h, при котором концентрация частиц уменьшается вдвое, обратно пропорционально массе частиц. Исходя из современных знаний можно вывести это чисто математически.
Зависимость концентрации молекул от высоты выражается барометрической формулой.  ; где n – концентрация молекул на некоторой высоте, n0 – концентрация молекул на поверхности земли. T- температура, R – универсальная газовая постоянная. m - масса молекулы. Для частиц взвешенных в жидкости (броуновских частиц) имеем
; где n – концентрация молекул на некоторой высоте, n0 – концентрация молекул на поверхности земли. T- температура, R – универсальная газовая постоянная. m - масса молекулы. Для частиц взвешенных в жидкости (броуновских частиц) имеем  . Перрен определил высоту при которой концентрация частиц водорода и броуновских частиц уменьшалась вдвое.
. Перрен определил высоту при которой концентрация частиц водорода и броуновских частиц уменьшалась вдвое.
 ,
,
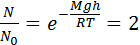 , отсюда
, отсюда
 .
.
Если основания равны значит и показатели степени равны. Отсюда  Перрен определил массу одной броуновской частицы. Она оказалась равной
Перрен определил массу одной броуновской частицы. Она оказалась равной
М=2,84·10 -18 грамма.
 Значит масса атома водорода равна
Значит масса атома водорода равна
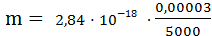 = 1,67·10-24 грамм.
= 1,67·10-24 грамм.
Масса атома водорода или 1 атомная единица массы равна 1,67·10-27 кг.1/12 массы атома углерода. Найдём отношение 1 грамма атомарного водорода к единице атомной массы, выраженной в граммах.
Мы получим число атомов водорода в одном грамме водорода. Умножив числитель и знаменатель на 4, получим, что в 4 граммах гелия находится такое же число молекул. Это число назвали числом Авогадро, а количество вещества, в котором содержится число моле  кул, равное числу Авогадро назвали молем. Часто в физике и химии пользуются молярной массой. Моль – масса вещества, выраженная в граммах, которая численно равна молекулярной массе в углеродных единицах. Для воды молярная масса равна М = 16+1+1=18 г/моль или в системе «СИ» М=18х10-3кг/моль. В одном моле любого вещества содержится 6,023х1023 молекул. Массу молекулы можно найти по формуле mo=M/NA , а число молекул,
кул, равное числу Авогадро назвали молем. Часто в физике и химии пользуются молярной массой. Моль – масса вещества, выраженная в граммах, которая численно равна молекулярной массе в углеродных единицах. Для воды молярная масса равна М = 16+1+1=18 г/моль или в системе «СИ» М=18х10-3кг/моль. В одном моле любого вещества содержится 6,023х1023 молекул. Массу молекулы можно найти по формуле mo=M/NA , а число молекул,  , где m/M = ν число молей, отсюда
, где m/M = ν число молей, отсюда  . Число молекул в единице объёма называют концентрацией молекул n=N/V.В телах молекулы располагаются на некотором расстоянии друг от друга. У твёрдых и жидких тел эти расстояния невелики по сравнению с размерами самих молекул. У газообразных тел расстояния между молекулами могут быть любыми. О наличии промежутков между молекулами говорят следующие факты; тела можно сжать под действием внешних нагрузок; тела изменяют объём при изменении температуры; диффузия.
. Число молекул в единице объёма называют концентрацией молекул n=N/V.В телах молекулы располагаются на некотором расстоянии друг от друга. У твёрдых и жидких тел эти расстояния невелики по сравнению с размерами самих молекул. У газообразных тел расстояния между молекулами могут быть любыми. О наличии промежутков между молекулами говорят следующие факты; тела можно сжать под действием внешних нагрузок; тела изменяют объём при изменении температуры; диффузия.
| Рисунок 1 Насыщение стали углеродом |
 Молекулы находятся в непрерывном хаотическом движении, вид которого зависит от агрегатного состояния вещества. Доказательством этого служит диффузия - самопроизвольное перемешивание, которое наблюдается в газообразном, жидком и твёрдом состоянии. Скорость диффузии зависит от температуры, рода вещества и его состояния (см. «Потоки»). Диффузия - это наше дыхание. Диффузия широко применяется и технике, например, Для легирования поверхностного слоя металлов (цементация, азотирование, и т.д.). Движением молекул объясняется «броуновское движение». Броуновское движение – хаотическое движение взвешенных в газе или жидкости мельчайших твёрдых частиц. Молекулы, которых не видно, ударяют в крупную частицу, которую уже можно наблюдать, и частица совершает беспорядочное движение.
Молекулы находятся в непрерывном хаотическом движении, вид которого зависит от агрегатного состояния вещества. Доказательством этого служит диффузия - самопроизвольное перемешивание, которое наблюдается в газообразном, жидком и твёрдом состоянии. Скорость диффузии зависит от температуры, рода вещества и его состояния (см. «Потоки»). Диффузия - это наше дыхание. Диффузия широко применяется и технике, например, Для легирования поверхностного слоя металлов (цементация, азотирование, и т.д.). Движением молекул объясняется «броуновское движение». Броуновское движение – хаотическое движение взвешенных в газе или жидкости мельчайших твёрдых частиц. Молекулы, которых не видно, ударяют в крупную частицу, которую уже можно наблюдать, и частица совершает беспорядочное движение.
Молекулы взаимодействуют: притягиваются и отталкиваются (см. Силы). Доказательством этого является существование твёрдых и жидких тел. Взаимодействие обусловлено тем, что молекулы состоят из заряженных частиц.
Вопросы:
1. Назовите основные положения молекулярно-кинетической теории.
2. Что называется броуновским движением?
3. Что называется молекулой?
4. Кто провёл систематизацию химических элементов?
5. Запишите барометрическую формулу.
6. Что называется числом Авогадро?
7. Что называется диффузией?
8. Что такое цементация?
ЗАДАЧИ
1. Сколько молекул находится в 1 кг кислорода?
2. Определите массу одной молекулы серной кислоты.
3. Зная, что в одном моле вещества 6,02 • 1023 молекул, найдите массу молекулы азота, если известно, что молярная масса равна.
4. Какую массу имеют 2×1023 молекул кислорода?
5. За 5 суток полностью испарилось 5×10 -2 кг спирта. Сколько в среднем молекул вылетало с поверхности за 1 с?
7. Какой объем занимают 100 моль железа?
8. Определите диаметр молекулы масла по масляному пятну площадью 12,3×10-2 м2, разлитому по поверхности воды, если образовался слой в одну молекулу. Масса капли масла 0,088×10-6 кг, а плотность масла 800 кг/м3.
ДОМАШНЕЕ ЗАДАНИЕ 1
1. Сколько молекул находится в 5 кг водорода?
2. Определите массу одной молекулы соляной кислоты.
3. Зная, что в одном моле вещества 6,02 • 1023 молекул, найдите массу молекулы углекислого газа, если известно.
4. Какую массу имеют 220×1023 молекул азота?
5. За 5 суток полностью испарилось 5×10 -2 кг бензина. Сколько в среднем молекул вылетало с поверхности за 1 с?
7. Какой объем занимают 100 моль никеля?
8. Определите диаметр молекулы масла по масляному пятну площадью 25×10-2 м2, разлитому по поверхности воды, если образовался слой в одну молекулу. Масса капли масла 0,1×10-6 кг, а плотность масла 700 кг/м3.
ЭНЕРГИЯ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. ВНУТРЕННЯЯ ЭНЕРГТЯ.
 ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ.
ИЗМЕНЕНИЕ ВНУТРЕННЕЙ ЭНЕРГИИ.
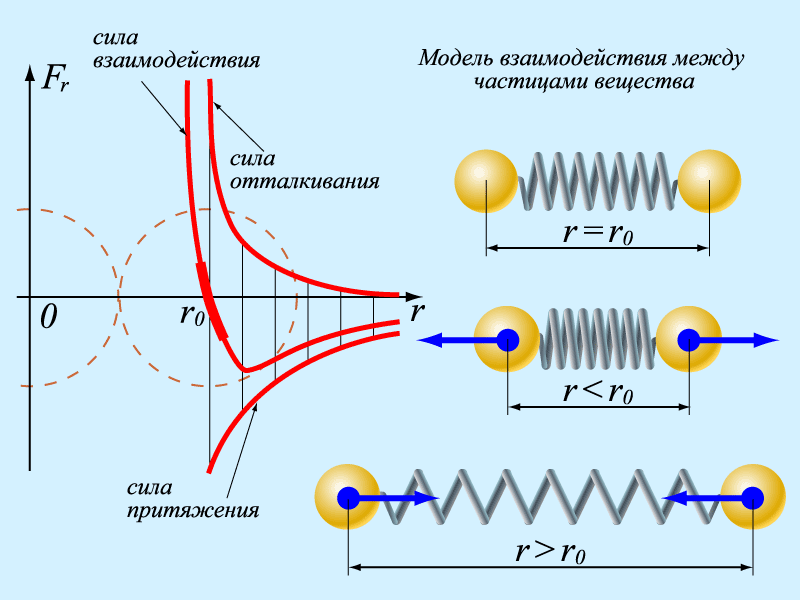
Молекула – нейтральная частица. Но, как показываю опыты, и они взаимодействуют. Природа взаимодействия молекул – электромагнитная. Мы знаем, что и нейтральные частицы-диполи могут притягиваться. Молекулы взаимодействуют силами еще более короткодействующими. Но при слишком близком приближении молекул взаимодействие электронов с ядром становится менее значительным, и на первые роли выходит отталкивание положительно заряженных ядер атомов. Результирующая сила изображается довольно сложной кривой с явно выраженной впадиной.
Но есть участок с прямолинейной зависимостью. Это говорит о том, что при малых деформациях сила пропорциональна величине деформации. Две заряженные, взаимодействующие частицы обладают энергией взаимодействия. График зависимости энергии взаимодействия молекул от расстояния между ними выглядит примерно так же, как график сил. Он имеет характерную потенциальную яму. При r = ro потенциальная энергия минимальна. При r < ro энергия резко возрастает. При r >
ro энергия тоже возрастает, но при большом увеличении расстояния энергия стремится к нулю, происходит разрыв молекулярных связей.
Итак, молекулы двигаются и взаимодействуют, т.е. молекулы обладают энергией взаимодействия (потенциальной) и энергией движения (кинетической). Сумма кинетической и потенциальной энергий частиц составляющих тело называется внутренней энергией тела – U. В тепловых процессах, под внутренней энергией понимается энергия молекул. U=åWп+åWk,
где Wп – потенциальная энергия молекулы, Wk – кинетическая энергия молекулы. Агрегатное состояние вещества зависит от соотношения Wп и Wk. Если Wп > Wk – тело находится в твёрдом состоянии. Если Wп ≈ Wk – тело находится в жидком состоянии. Если Wп << Wk – тело в газообразном состоянии. Чем больше кинетическая энергия молекул, тем больше их скорость. Скорость молекул зависит от температуры (чем больше температура, тем быстрее диффузия). Поэтому, чем больше температура тела, тем больше его внутренняя энергия.
Внутренняя энергия может изменяться. Существуют два способа изменения внутренней энергии.
1. Внутренняя энергия может изменяться за счёт других видов энергии: электрической, механической и т.д. Изменение энергии с превращением её в другие виды определяется работой. Для этого случая DU=DWмех, или DU=Aмех. При ударе тел, при пропускании тока через проводник происходит нагревание, т.е. увеличение внутренней энергии.
2. Внутренняя энергия одного тела может изменяться за счёт внутренней энергии других тел. Энергия молекул одного тела передаётся молекулам другого тела без превращений. Работа не совершается. DU1= DU2 – на сколько увеличилась внутренняя энергия одного тела, на столько уменьшилась внутренняя энергия второго. Часть внутренней энергии, переданная другому телу, называется количеством теплоты – Q. Процесс передачи тепла называется теплообменом. При непосредственном контакте – теплопроводность, при передаче тепла потоками жидкости или газа – конвекция, с помощью электромагнитных волн – излучение. Изменение внутренней энергии можно записать - DU=Q, или Q1=Q2. В общем случае может происходить и теплообмен, и совершаться работа поэтому
DU=А+Q –это первое начало термодинамики (закон сохранения энергии для тепловых процессов).
Изменение внутренней энергии можно определить по следующим формулам: Q=cmDt – при нагревании тела, Q= rm – при испарении, Q=lm – при плавлении, Q=qm – при горении, где с, r, l, q –соответственно: удельная теплоёмкость, удельная теплота парообразования, удельная теплота плавления, удельная теплота сгорания топлива.
|
из
5.00
|
Обсуждение в статье: ЭНЕРГИЯ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. ВНУТРЕННЯЯ ЭНЕРГТЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

