 |
Главная |
Конденсационные методы
|
из
5.00
|
Методы диспергирования
Механическое измельчение - заключается в энергичном и длительном растирании, размалывании или распылении дисперсной фазы и смешивании его с дисперсионной средой. Для устойчивости образующегося золя добавляется стабилизатор. Дробление осуществляют с помощью коллоидных мельниц, вальцов, ступок и т.п.
Электрическое диспергирование – состоит в получении золей металлов при контакте двух металлических электродов при пропускании через них тока силой 5 – 10 А и напряжением на электродах 100 В.В области возникшей дуги отрываются частицы от электродов, поступают в среду и образуют золь. Так получают гидрозоли серебра, платины, золота. Их используют в медицине как антисептические лекарственные вещества.
Диспергирование ультразвуком – используют для дробления непрочных веществ с помощью ультразвуковых колебаний с частотой выше 20000 Гц.
Пептизация – переход в коллоидный раствор осадков под влиянием дисперсионной среды, содержащей пептизатор. Пептизации поддаются только свежие осадки, они легко переходят в золь, а старые, как правило, не пептизируются. Пептизацию можно наблюдать при "восстановлении" сухого молока, где пептизатором является белок.
Конденсационные методы
Метод замены растворителя (физическая конденсация) – основан на замене одного растворителя другим. Если истинный раствор поваренной соли в этиловом спирте по каплям добавлять в эфир, то образуется золь поваренной соли в эфире. При этом ионы Na+ и Cl־ образуют коллоидные частицы из-за плохой растворимости хлорида натрия в эфире.
Метод химической конденсации сводится к образованию молекул нерастворимых веществ с последующей их конденсацией до размеров коллоидных частиц. При этом могут использоваться реакции обмена, гидролиза, окисления – восстановления.
После получения золей коллоидных растворов их необходимо очищать от электролитов, которые понижают их устойчивость и мешают изучению их свойств.
Очистку золей проводят методом диализа, а используемые для этого устройства называют диализаторами. В них имеется полупроницаемая перегородка, через которую проходят ионы и молекулы низкомолекулярных веществ, но задерживаются крупные по размеру коллоидные частицы. Для ускорения этого процесса применяют электрическое поле и устройства называютсяэлектродиализаторами. Диализ применяют для очистки пищевого желатина, клея, красителей, целлюлозы, для удаления солей из молочной сыворотки с целью сохранения в ней лактозы и протеинов. Диализ наблюдается при вымачивании соленого мяса и рыбы.
Метод отделения дисперсной фазы от дисперсионной среды фильтрованием коллоидных растворов через полупроницаемые мембраны называется ультрафильтрацией. Для этих целей используют также центрифуги и ультрацентрифуги. Центрифугирование, например, применяется для сепарирования молока, отделения мелкокристаллических осадков и т.п.
5.устойчивость-неизменность во времени основных параметров дисп.с-мы:степени дисп-ти и равномерного распределения частиц дис.фазы в дисп.среде. о предложению Н.П. Пескова (1920г) устойчивость дисперсных систем подразделяют на два вида:кинетическая(седиментационная) устойчивость – свойство дисперсных частиц удерживаться во взвешенном состоянии, не оседая (противостояние частиц силам тяжести).агрегативнаяустойчивость – способность частиц дисперсной фазы оказывать сопротивление слипанию (агрегации) и тем самым сохранять определенную степень дисперсности этой фазы в целом. Дисперсные системы по устойчивости делят на два класса:термодинамически устойчивые (лиофильные коллоиды);термодинамически неустойчивые (лиофобные системы).Первые самопроизвольно диспергируются и существуют без стабилизатора. К ним относятся растворы ПАВ, растворы ВМС.
GDСвободная энергия Гиббса термодинамически устойчивой системы уменьшается (<0).
GDК термодинамически неустойчивым системам относятся золи, суспензии, эмульсии (>0).
В последнее время различают также конденсационную устойчивость: система образует непрочные агрегаты (флокулы) или рыхлые осадки – частицы теряют свою индивидуальную подвижность, но сохраняются как таковые в течение длительного времени. Лиофобные коллоиды являются термодинамически неустойчивыми системами, существующими благодаря стабилизации за счет возникновения защитных ионных или молекулярных слоев. Следовательно, изменение состояния этих слоев может привести к потере устойчивости и затем к выделению дисперсной фазы. Устойчивость определяется результатом борьбы сил тяжести и броуновского движения. Это пример проявления закона единства и борьбы противоположностей. Факторы, определяющие устойчивость систем: броуновское движение, дисперсность частиц дисперсной фазы, вязкость и ионный состав дисперсионной среды и т.д.
Факторы устойчивости коллоидных растворов: наличие электрического заряда коллоидных частиц. Частицы несут одноименный заряд, поэтому при встрече частицы отталкиваются; способность к сольватации (гидратации) ионов диффузного слоя. Чем более гидратированы ионы в диффузном слое, тем толще общая гидратная оболочка, тем стабильнее система. Упругие силы сольватных слоев оказывают расклинивающее действие на дисперсные частицы и не дают им сближаться; адсорбционно-структурирующие свойства систем. Третий фактор связан с адсорбционными свойствами дисперсных систем. На развитой поверхности дисперсной фазы легко абсорбируются молекулы поверхностно-активных веществ (ПАВ) и высокомолекулярных соединений (ВМС).
6.коагуляция-процесс разрушения коллоидных систем засчет слипания частиц,образования более крупных агрегатов с потерей устойчивости и последующим разделением фаз. порог коагуляции-наим-ая концентрация электролита,достаточная для того,чтобы вызвать коагуляцию золя. y=VC\W. Порог коагуляции определяют по помутнению, изменению окраски или по началу выделения дисперсной фазы в осадок.Правило Шульце-Гарди: Коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду потенциалопределяющих ионов мицеллы (гранулы), причем, коагулирующее действие тем сильнее, чем выше заряд.
 где К – коагулирующая способность (примем ее за единицу).
где К – коагулирующая способность (примем ее за единицу).
По правилу Шульца – Гарди чем выше заряд, тем меньше требуется электролита, чтобы вызвать коагуляцию. Коагуляция золя может быть вызвана его взаимодействием с другим золем, частицы которого имеют противоположный заряд. Так, смешение золя гидроксида железа, частицы которого имеют положительный заряд, с отрицательно заряженным золем сульфида мышьяка приводит к их взаимной коагуляции.
7. Явления, происходящие на поверхности раздела фаз называются поверхностными явлениями. Адсорбция- это явление концентрирования вещества на поверхности раздела фаз. Адсорбент - вещество, на поверхности которого происходит адсорбция. Адсорбат(адсорбтив) - это вещество, адсорбирующееся на поверхности адсорбента. Поверхность, приходящаяся на 1 г адсорбента, называется удельной поверхностью адсорбента (Sуд). Изотерма Генри: Г = kРили Г = kС .т. е. заполнение поверхности пропорционально давлению адсорбата в газовой фазе Р или его концентрации С в «области Генри», т. е. в области небольших Р или С. Теория мономолекулярной адсорбции. Изотерма Ленгмюра.Адсорбция бывает нелокализованная (молекулы адсорбата могут свободно перемещаться вдоль поверхности адсорбента). Локализованная адсорбция - это химическая или сильная физическая адсорбция, при которой адсорбированная молекула прочно связана с адсорбентом и не может перемещаться вдоль поверхности.Мономолекулярная локализованная адсорбция описывается уравнением изотермы адсорбции Ленгмюра: 
 , где Г - величина адсорбции газа, Г∞ - максимально возможное количество адсорбированного вещества при образовании мономолекулярного слоя адсорбата, т. е. предельная адсорбция, в - константа адсорбционного равновесия, Р - равновесное давление газа. Теория полимолекулярной адсорбции. Изотерма БЭТ.Для полимолекулярной адсорбции на твердом адсорбенте Брунауэр, Эммет и Теллер вывели уравнение изотермы адсорбции (БЭТ):
, где Г - величина адсорбции газа, Г∞ - максимально возможное количество адсорбированного вещества при образовании мономолекулярного слоя адсорбата, т. е. предельная адсорбция, в - константа адсорбционного равновесия, Р - равновесное давление газа. Теория полимолекулярной адсорбции. Изотерма БЭТ.Для полимолекулярной адсорбции на твердом адсорбенте Брунауэр, Эммет и Теллер вывели уравнение изотермы адсорбции (БЭТ):  где V- общий объем адсорбированного газа, Vm - объем адсорбированного газа, соответствующий мономолекулярному покрытию всей поверхности адсорбента, Р - равновесное давление адсорбированногогаза, Ps- давление насыщенного пара, с - константа при данной температуре.
где V- общий объем адсорбированного газа, Vm - объем адсорбированного газа, соответствующий мономолекулярному покрытию всей поверхности адсорбента, Р - равновесное давление адсорбированногогаза, Ps- давление насыщенного пара, с - константа при данной температуре.  Для средних заполнений поверхности адсорбента используют уравнение изотермы Фрейндлиха:
Для средних заполнений поверхности адсорбента используют уравнение изотермы Фрейндлиха:
Г =  = k
= k  (адсорбция из газовой фазы); Г =
(адсорбция из газовой фазы); Г =  = k
= k  (адсорбция из раствора), где x - количество адсорбированного вещества, моль, m - масса адсорбента в граммах, k и α- константы.
(адсорбция из раствора), где x - количество адсорбированного вещества, моль, m - масса адсорбента в граммах, k и α- константы. 
Адсорбция на границе газ-жидкость. Изотерма Гиббса. 
8.Поверхностно-неактивные вещества стремятся уйти с поверхности жидкости в объеме. Поверхностно-активные вещества, наоборот, стремятся накапливаться в поверхностном слое. Накопление вещества поверхностным слоем называется адсорбцией. Характерной особенностью всех поверхностно-активных веществ является их дифильность, то есть то, что они состоят из двух частей – полярной группы и неполярного углеводородного или ароматического радикала. ПАВ - это органические кислоты, спирты, эфиры, амины, кетоны, мыла и другие моющие средства. Молекулы ПАВ при внесении их в воду стремятся выйти на границу раздела вода/пар, где каждая из указанных частей молекул ориентируется соответственно своей природе: полярная группа - в сторону полярной среды (в воду), неполярная - в воздух. Для поверхностно-активных веществ  уменьшается с концентрацией, то есть
уменьшается с концентрацией, то есть  . Для поверхностно-неактивных веществ
. Для поверхностно-неактивных веществ  увеличивается с концентрацией то есть
увеличивается с концентрацией то есть  . Если
. Если  не зависит от концентрации
не зависит от концентрации 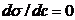 .Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 разаПоверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ2-группу.
.Правило Дюкло-Траубе — зависимость, связывающая поверхностную активность водного раствора органического вещества с длиной углеводородного радикала в составе его молекулы. Согласно этому правилу, при увеличении длины углеводородного радикала на одну группу СΗ2 поверхностная активность вещества увеличивается в среднем в 3,2 разаПоверхностная активность зависит от строения молекул ПАВ; последние обычно состоят из полярной части (группы, обладающие большим дипольным моментом) и неполярной части (алифатические или ароматические радикалы). В границах гомологического ряда органических веществ, концентрация, необходимая для понижения поверхностного натяжения водного раствора до определённого уровня, снижается в 3-3,5 раза при увеличения углеродного радикала на одну -СΗ2-группу.
9.Величина работы, необходимой для создания единицы площади новой поверхности, называется поверхностным натяжением, которое выражается в Дж/м2 и обозначается буквой  (сигма).
(сигма).
 =А/S
=А/S
На легкоподвижных границах жидкость — газ (пар) или жидкость — жидкость П. н. можно непосредственно измерить многими методами. Так, широко распространены способы определения П. н. по массе капли, отрывающейся от конца вертикальной трубки (сталагмометра); по величине максимального давления, необходимого для продавливания в жидкость пузырька газа; по форме капли (или пузырька), лежащей на плоской поверхности, и т.д. Экспериментальное определение П. н. твёрдых тел затруднено из-за того, что их молекулы (или атомы) лишены возможности свободного перемещения. Исключение составляет пластическое течение металлов при температурах, близких к точке плавления. Ввиду анизотропии кристаллов П. н. на разных гранях кристалла различно. Понятия П. н. и свободной поверхностной энергии для твёрдых тел не тождественны. Дефекты кристаллической решётки, главным образом дислокации, ребра и вершины кристаллов, границы зёрен поликристаллических тел, выходящие на поверхность, вносят свой вклад в свободную поверхностную энергию. П. н. твёрдых тел обычно определяют косвенно, исходя из межмолекулярных и межатомных взаимодействий. Величиной и изменениями П. н. обусловлены многие поверхностные явления, особенно в дисперсных системах.
В живых организмах П. н. клетки — один из факторов, определяющих форму целой клетки и её частей. Для клеток, обладающих жёсткой или полужёсткой поверхностью (многие микроорганизмы, инфузории, клетки растений и т.д.), значение П. н. невелико. У клеток, лишённых прочной надмембранной структуры (большинство клеток животных, некоторые простейшие, сферопласты бактерий), П. н. в основном определяет конфигурацию (клетки, находящиеся во взвешенном в жидкости состоянии, приобретают форму, близкую к сферической). Форма клетки, прикрепленной к какому-либо субстрату или к др. клеткам, зависит преимущественно от др. факторов — цитоскелета, образуемого микротрубочками, контактных структур и т.д. Полагают, что локальные изменения П. н. существенны в таких явлениях, как фагоцитоз, пиноцитоз, гаструляция. Определение П. н. клетки — сложная экспериментальная задача; обычно П. н. клетки не превышает несколько дин/см (10-3н/м)
10. Адсорбция на твердой поверхности из раствора зависит от природы растворенного вещества. Большое влияние оказывает на адсорбцию соотношение полярностей адсорбента и растворителя. Это выражается правилом уравнивания полярностей Ребиндера
|
из
5.00
|
Обсуждение в статье: Конденсационные методы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

