 |
Главная |
Структура стёкол и методы ее изучения
|
из
5.00
|
Наиболее широко применяются рентгеноструктурный и рентгенофазовый анализы (РСА и РФА). Для кристаллов интенсивность поглощения рентгеновских лучей или их рассеяния как функция от направленности луча характеризуется зависимостью с резко выраженными максимумами (рис. 2.2).

Рис. 2.2 Рентгенограмма кристаллических веществ
По положению пиков, характеризующих межплоскостные расстояния, определяют параметры кристаллической решётки. С использованием специальных таблиц брэгговский угол переводят в межатомные расстояния. Рентгенограмма стеклообразного состояния характеризуется аморфным гало (рис. 2.3).

Рис.2.3 Рентгенограмма стекла
Следовательно, в стекле отсутствует дальний порядок, нет периодичности расположения элементов структуры.
Интересные сведения можно получить из анализа инфракрасных спектров поглощения стёкол. Методом ИК – спектроскопии обнаружили, что каждой группировке атомов, соединённых валентными связями, соответствует своя полоса поглощения (рис. 2.4).
Рис. 2.4 Спектр инфракрасного поглощения
(υ – волновое число, см-1)
Полосы поглощения характеризуют колебания атомов вдоль линий валентных связей. Фиксируются группировки ≡Si−O−Si≡ (υ=1100 см-1), ≡Si−O− Na+ (υ=1000-950 см-1). Свои полосы поглощения имеют группировки [ВО3],[ВО4] и другие кислородные полиэдры.
Используя зависимости интенсивности рассеяния от угла скольжения Ө, изучили функцию радиального расположения атомов в стекле.
Выберем внутри стекла шаровой слой с внутренним радиусом r и наружным r+dr с центром в ядре произвольно выбранного атома кремния. Среднее число атомов dn(r), попавших в этот шаровой слой, пропорционально объему слоя 4πr2∙dr и некоторому множителю R(r), зависящему от расстояния r.
Число атомов, оказавшихся в этом шаровом слое, равно
dn(r) = 4πr2∙dr∙R(r),
здесь R(r) – парная функция радиального распределения, характеризующая плотность частиц.
1. На расстояниях r, много больших межатомного расстояния, атомы не испытывают влияние центрального атома и располагаются независимо от него.
R(r) = Rо – средняя плотность числа частиц в стекле.
2. Если расстояние r меньше радиуса атома кремния, то в шаровой слой не попадет ни один соседний атом. Поэтому здесь R(r)=0 (рис. 2.5).

Рис. 2.5 Функция радиального распределения атомов
в кварцевом стекле
Квадратичная парабола характеризует распределение частиц при постоянной плотности Rо, т.е. на больших расстояниях от центрального атома. В промежуточной области, при приближении к выбранному атому кремния, функция радиального распределения атомов (ФРРА) осциллирует (колеблется) около квадратичной параболы и имеет несколько минимумов или максимумов. Первичная информация, используемая для построения функции радиального распределения – экспериментальная зависимость интенсивности рассеяния рентгеновских лучей или электронов от угла скольжения. ФРРА для кварцевого стекла впервые получил в 1936 году Уоррен с сотрудниками.
Первый максимум характеризует ближайшее окружение атома кремния, т.е. расстояние между кремнием и кислородом. Второй максимум отражает расстояние между атомами кислорода. Третий максимум показывает расстояние между атомами кремния.
r (Si – O) = 0,162 нм.
r (O − O) = 0,265 нм.
r (Si – Si) = 0,320 нм.
По площади под первым максимумом рассчитали координационное число атомов кремния. Оно оказалось равным 4, т.е. каждый атом кремния окружают четыре атома кислорода.
Центральный атом кремния не только создаёт устойчивое окружение из четырёх атомов кислорода, но и организует около кислородного полиэдра группировку из нескольких тетраэдров SiO4. Через 2-3 параметра решетки упорядоченность в расположении атомов исчезает. В качестве центрального может выступать любой атом кремния. Силовые поля этого атома способны ориентировать в пространстве ближайшие 4-6 кремнекислородных тетраэдра.
Этим и другими методами показано, что стёклам присущ только ближний порядок расположения атомов. Дальний порядок – периодическое расположение атомов или их групп в пространстве, создающее геометрически правильную трёхмерную решётку. Для кристаллической структуры характерен как ближний, так и дальний порядок расположения атомов.
И в кристаллах и в расплаве диоксида кремния основным структурным элементом являются кремнекислородные тетраэдры (рис. 2.6). Как в стеклообразных, так и в кристаллических силикатных системах тетраэдры SiO44- , соединяясь через вершины, способны образовывать в одном, двух или трёх направлениях непрерывную сетку.

Рис. 2.6 Строение кремнекислородного тетраэдра
Структура кремнекислородного комплекса определяется электронным строением атома кремния. Атом кремния в нормальном состоянии имеет электронную конфигурацию:
Si: 1s22s22p63s23р2
В возбужденном состоянии внешняя оболочка меняется:
Si*: 1s22s22p63s13p3
В возбужденном состоянии атом кремния имеет четыре неспаренных электрона. При образовании связей для атома кремния характерна sp3 гибридизация внешних электронных орбиталей. Образуются четыре равноценные гибридные sp3-орбитали, ориентированные в пространстве к четырём вершинам правильного тетраэдра под углом 109о28΄ друг к другу.
За счёт перекрывания этих орбиталей с одной из двух 2р-орбиталей атома кислорода с неспаренными электронами образуются четыре равноценные ординарные σ-связи. Возникает тетраэдрическая группа [SiO4] c углом связи Si-O, равным 109о28΄. Причём каждый атом кислорода использует на эту связь один из двух своих неспаренных электронов на 2р-орбитали.
При связывании тетраэдров атом кислорода отдаёт для связи со вторым атомом кремния прежде всего свой второй неспаренный электрон на 2р-орбитали. Эти две р-орбитали атома кислорода, как показывают рентгенографические исследования, могут располагаться в пространстве под разными углами. Следствием является образование различных модификаций кристаллического кремнезёма (табл. 2.1, рис. 2.7).
Таблица 2.1
Взаимная ориентация кремнекислородных тетраэдров в различных модификациях кремнезёма
| Модификация кремнезёма | Угол связи Si-O-Si (град.) |
| b-кварц (низкотемпературный) | 143 – 147 |
| α-кварц (высокотемпературный) | 146 – 155 |
| b-кристобалит (низкотемпературный) | 147 – 150 |
| α-кристобалит (высокотемпературный) | 152 – 180 |
| Стеклообразный кремнезём | 120 – 180 |

SiO2 кристаллический
Рис. 2.7. Плоская модель структуры кристаллического
кремнезёма
В расплаве диоксида кремния тетраэдры, объединяясь, образуют относительно упорядоченные области [SiO4]n. Линейный размер групп не менее 1,4-1,5 нм. Группа представляет собой 4-6 тетраэдров, соединённых вершинами. Ковалентная составляющая химической связи внутри тетраэдров [SiO4], обусловленная sp3 гибридизацией, является более жёсткой, чем между тетраэдрами, которая осуществляется только за счёт перекрытия р-орбиталей.
Ориентация sp3 орбиталей атома кремния в пространстве очень устойчивая. Поэтому тетраэдр SiO4 всегда сохраняет свои геометрические параметры. Связь тетраэдра с другими тетраэдрами реализуется за счет второго р-электрона атома кислорода. Эта связь между двумя р-орбиталями атома кислорода подобна шарнирной, она допускает различное расположение тетраэдров. Поэтому углы связи между тетраэдрами легко изменяются и структура легко искажается. В расплавленном диоксиде кремния эти искажения проявляются уже в третьем тетраэдре относительно произвольно выбранного.
Даже в простейшем по составу расплаве кремнезёма наблюдается «микронеоднородность» строения, обусловленная объединением тетраэдров [SiO4] в отдельные группировки. Сопоставляя полученные сведения с кристаллитной гипотезой, отметим подвижность, относительность микрогруппировок в стекле. Если гипотеза Лебедева предполагала неподвижность, статичность микрокристаллитных образований, то в действительности в кварцевом стекле каждый атом кремния создаёт около себя локальную структурную упорядоченность. Причём наблюдается двойственность функций атомов кремния в структуре стекла. Атом кремния, периферийный для выбранного центрального атома кремния, параллельно, в свою очередь также является центральным для несколько иного окружения, в котором прежде центральный атом кремния становится периферийным.
Структура кварцевого стекла – тетраэдры SiO4, соединённые друг с другом вершинами через атомы кислорода. В стекле тетраэдры SiO4 не образуют в пространстве геометрически правильных сочленений, характерных для кристобалита. Структурная сетка стекла – искажённая кристаллическая решётка. Искажения обусловлены варьированием угла связи Si−O−Si между соседними тетраэдрами. Для кристаллических форм углы связи строго определенные и разные для разных модификаций. Для стекла углы связи меняются в широких пределах, но преобладают характерные для α и β-кварца и β-кристобалита (рис. 2.8).
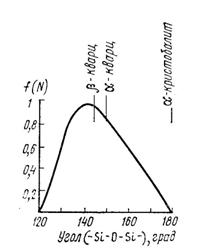
Рис. 2.8. Взаимная ориентация кремнекислородных тетраэдров в кварцевом стекле (максимум при 144о)
|
из
5.00
|
Обсуждение в статье: Структура стёкол и методы ее изучения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

