 |
Главная |
Гидролиз как обменный процесс. Необратимый гидролиз органических и неорганических соединений и его значение в практической деятельности человека
|
из
5.00
|
Гидролиз-это обменное взаимодействие веществ с водой приводящее к их разложению.Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, то есть вещества, которые при данных условиях не могут провзаимодействовать между собой. Необратимый гидролиз является химической реакцией, так как реагирующие вещества взаимодействуют практически полностью.
15. Окислительно-восстановительные реакции. Классификация окислительно-восстановительных реакций.
К окислительно-восстановительным реакциям могут быть отнесены химические реакции следующих типов.1)Реакции замещения (вытеснения)
Примером реакций этого типа может служить реакция между оксидом железа (III) и алюминием. В этой реакции алюминий вытесняет железо из раствора, причем сам алюминий окисляется, а железо восстанавливается.  2)Реакции металла с кислотами
2)Реакции металла с кислотами
Эти реакции, в сущности, тоже представляют собой реакции замещения. В качестве примера приведем реакцию между медью и азотной кислотой. Медь вытесняет водород из кислоты. При этом происходит окисление меди, которая превращается в гидратированный катион, а содержащиеся в растворе кислоты гидратированные протоны азота восстанавливаются, образуя оксид азота.  3)Реакции металлов с водой.Эти реакции тоже принадлежат к типу реакций замещения. Они сопровождаются вытеснением из воды водорода в газообразном состоянии. В качестве примера приведем реакцию между металлическим натрием и водой:
3)Реакции металлов с водой.Эти реакции тоже принадлежат к типу реакций замещения. Они сопровождаются вытеснением из воды водорода в газообразном состоянии. В качестве примера приведем реакцию между металлическим натрием и водой:  4)Реакции металлов с неметаллами. Эти реакции могут быть отнесены к реакциям синтеза. В качестве примера приведем образование хлорида натрия в результате сгорания натрия в атмосфере хлора
4)Реакции металлов с неметаллами. Эти реакции могут быть отнесены к реакциям синтеза. В качестве примера приведем образование хлорида натрия в результате сгорания натрия в атмосфере хлора 
16. Металлы. Положение металлов в периодической системе и особенности строения их атомов.
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.  В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2 p1 . Они относятся к p-элементам.В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.Оксиды типа R2 O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2 , которые являются сильными окислителями. Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.Положение металлов в периодической системе: условная диагональ от B к At через элемента A групп: IV => V => VI. На диагонали и над ней расположены неметаллы, а под ней - металлы. Только из металлов состоят B группы. Всего из 110 элементов к металлам относят 88 элементов. IA группа - щелочные металлы, IIA группа - щелочноземельные металлы. Особенности строения атомов металлов: 1) число электронов на внешнем слое 1-3; 2) большой радиус.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2 p1 . Они относятся к p-элементам.В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.Оксиды типа R2 O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2 , которые являются сильными окислителями. Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.Положение металлов в периодической системе: условная диагональ от B к At через элемента A групп: IV => V => VI. На диагонали и над ней расположены неметаллы, а под ней - металлы. Только из металлов состоят B группы. Всего из 110 элементов к металлам относят 88 элементов. IA группа - щелочные металлы, IIA группа - щелочноземельные металлы. Особенности строения атомов металлов: 1) число электронов на внешнем слое 1-3; 2) большой радиус.
17. Положение неметаллов в Периодической системе, особенности строения их атомов.
В периоде, у неметаллов: заряд ядра увеличивается; радиус атома уменьшается; число электронов на внешнем энергетическом уровне увеличивается; электроотрицательность увеличивается; окислительные свойства усиливаются; неметаллические свойства усиливаются.В группе у неметаллов заряд ядра увеличивается; радиус атома увеличивается; число электронов на внешнем энергетическом уровне не изменяется; электроотрицательность уменьшается; окислительные свойства ослабевают; неметаллические свойства ослабевают. Все простые вещества-неметаллы образованы атомами, связанными между собой ковалентной неполярной связью.Неметаллы образуют большое количество кислородных соединений – оксидов.
18. Водородные соединения неметаллов. Оксиды и ангидриды карбоновых кислот.
Гидриды . В соединениях с неметаллами водород проявляет степень окисления +1. Поскольку энергия ионизации водорода очень большая, химическая связь его с неметаллами не ионная, а полярно-ковалентная. Наиболее электроотрицательные р-элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами и сила этих кислот увеличивается по мере увеличения размера атома присоединяемого к водороду неметалла. Исключениями являются метан СН4 , представляющий собой нейтральное соединение, а также аммиак NH3 , обладающий основными свойствами. Водородные соединения неметаллов хорошо растворимы в воде и образуют кислоты с теми же формулами.Более электроотрицательные р-элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na2 O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода.
19. Основания органические и неорганические.
Основания — электролиты, при диссоциации которых образуется только один вид анионов — гидроксид-ионы. 
Классификация оснований:
1. Растворимые в воде (щелочи) — гидроксиды металлов главных подгрупп I и II групп. 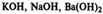
2. Нерастворимые в воде — гидроксиды остальных металлов. 
Химические свойства

 Получение оснований. Щелочи получают электролизом растворов солей.Электролиз раствора хлорида натрия. Процессы на катоде и аноде:
Получение оснований. Щелочи получают электролизом растворов солей.Электролиз раствора хлорида натрия. Процессы на катоде и аноде: 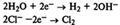
20. Кислоты органические и неорганические.
Кислота — сложное вещество, при диссоциации которого образуется только один тип катионов — ионы водорода. 
Классификация кислот.
 Соляная кислота — водный раствор газа хлоро-водорода в воде.Химические свойства.
Соляная кислота — водный раствор газа хлоро-водорода в воде.Химические свойства.
При реакции сосновными оксидами образуются соли: 
 Кислоты реагируют сметаллами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль:
Кислоты реагируют сметаллами, находящимися в ряду напряжений до водорода, при этом выделяется газообразный водород и образуется соль:
Получение кислот. Многие кислоты можно получить при реакции кислотных оксидов с водой:

Концентрированная серная кислота при обычной температуре не действует на многие металлы.При этом образуются соли серной кислоты, однако водород не выделяется, а получаются другие вещества, например сернистый газ.
21. Элементы IА-группы. Элементы IIА-группы.
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
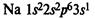 В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2 p1 . Они относятся к p-элементам.В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2 p1 . Они относятся к p-элементам.В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra.
22. Алюминий.
Алюминий расположен в 3-й группе главной подгруппы, в 3 периоде. Порядковый номер 13. Атомная масса ~27. Р-элемент. Электронная конфигурация: 1s22s22p63s23p1. На внешнем уровне 3s23p1 находятся 3 валентных электрона. Степень окисления +3, валентность – III.
Физические свойства: алюминий – металл серебристо-белого цвета, мягкий, механически прочный, тепло– и электропроводный, легко вытягивается в проволоку, прокатывается в тонкую фольгу, легко образует сплавы.Химические свойства: 4Аl + 3О2 = 2Аl2О3 2Аl + 6Н2О = 2Аl(ОН)3? + 3Н2
Получение. В промышленности алюминий получают электролизом раствора Аl2О3 в расплавленном криолите Na3AlF6 с добавлением СаF2. Алюминий выделяется на катоде.Нахождение в природе: алюминий – один из наиболее распространенных элементов в земной коре – до 250 руд, содержащих алюминий: боксит, корунд,рубин и сапфир – драгоценные камни; нефелин –– одна из важнейших алюминиевых руд.Применение алюминия и его соединений и сплавов: алюминий и его соединения применяется в быту и во всех отраслях народного хозяйства: в машиностроении, автостроении, в химической промышленности. При помощи алюмотерапии производят сварку рельсов, проводят сварочные работы под водой. Чистым алюминием покрывают бензобаки, что способствует предохранению бензина от теплового излучения.
23. Галогены. Общая характеристика на основании их положения в Периодической системе элементов Д.И.Менделеева и строения атомов. Важнейшие соединения галогенов, их свойства, значение и применение. Галогены в природе. Биологическая роль галогенов.
Галогены находятся вглавнойподгруппеVII группы периодической Системы химических элементов.
К галогенам относят фтор(F)-2 период,хлор(Cl)-3 период, бром(Br)-4 период, иод(I)-5 период и астат(At)-6 период.
Галогены – ярко выраженные неметаллы. Лишь йод в редких случаях обнаруживает некоторые свойства, схожие с металлами. Галогены имеют степень окисления +1,+3, +5, +7, -1.У фтора только -1.В природе наиболее распространен –хлор. Астат получен искусственным путем.В невозбужденном состоянии атомы галогенов имеют общие электронную конфигурацию: ns2np5 . Это значит, что галогены имеют 7 валентных электронов, кроме фтора.Физические свойства галогенов: F2 – бесцветный, трудно сжижающийся газ; Cl2 – желто-зеленый, легко сжижающийся газ с резким удушливым запахом; Br2 – жидкость красно-бурого цвета; I2 – кристаллическое вещество фиолетового цвета.
Водные растворы галогеноводородов образуют кислоты. НF – фтороводородная (плавиковая); НCl – хлороводородная (соляная); НBr – бромоводородная; НI – йодоводородная. Силы кислот сверху вниз снижаются. Плавиковая кислота является самой слабой в ряду галогеново-дородных кислот, а йодоводородная – самой сильной. Это объясняется тем, что энергия связи Нг сверху уменьшается. В том же направлении уменьшается и прочность молекулы Н Г, что связано с ростом межъядерного расстояния. Растворимость малорастворимых солей в воде тоже уменьшается:
Слева направо растворимость галогенидов уменьшается. АgF хорошо растворим в воде. Все галогены в свободном состоянии – окислители . Сила их как окислителей снижается от фтора к йоду. В кристаллическом, жидком и газообразном состоянии все галогены существуют в виде отдельных молекул. Атомные радиусы возрастают в том же направлении, что приводит к повышению температуры плавления и кипения. Фтор диссоциирует на атомы лучше йода. Электродные потенциалы при переходе вниз по подгруппе галогенов снижаются. У фтора самый высокий электродный потенциал. Фтор – самый сильный окислитель . Любой вышестоящий свободный галоген вытеснит нижестоящий, находящийся в состоянии отрицательного однозарядного иона в растворе.
|
из
5.00
|
Обсуждение в статье: Гидролиз как обменный процесс. Необратимый гидролиз органических и неорганических соединений и его значение в практической деятельности человека |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

