 |
Главная |
Термодинамическое описание систем разделения
|
из
5.00
|
Типовые задачи и методы ТВК.
Термодинамика при конечном времени (ТВК) используется для анализа, оценки предельных возможностей и выявления направлений совершенствования различных технологических процессов.
К типовым задачам ТВК относится составление балансовых уравнений для вещества, энергии и энтропии внешних по отношению к процессу потоков.
Уравнения термодинамических балансов – материальных, энергетического и энтропийного - связывают между собой параметры входных и выходных потоков в стационарном режиме. Балансовые уравнения позволяют выявить зависимость между параметрами внешних потоков (расходами, концентрациями, температурами, давлениями и т.д.) и количеством производимой в процессе энтропии. В обратимых процессах производство энтропии равно нулю, в необратимых – больше нуля. Отсюда следуют ограничения, накладываемые на входные потоки – выделяется множество достижимости в пространстве параметров входных и выходных потоков. Если же на систему наложить дополнительное условие заданной средней интенсивности или конечной продолжительности, то можно найти минимально возможное при данных ограничениях производство энтропии (рассеяние энергии). В реальных системах производство энтропии меньше минимально возможного, что сужает область достижимости.
Основываясь на балансовых уравнениях, можно исследовать характер зависимостей между традиционными показателями эффективности технологического процесса (производительность, КПД, и т.д.) и термодинамическими – количеством рассеянной (диссипированной) энергии и производимой энтропией. Как правило, эти зависимости монотонно ухудшаются с ростом диссипации и достигают своих предельных значений в обратимом процессе, что позволяет получить оценки, аналогичные КПД Карно для процессов самой разной природы.
Производство энтропии является мерой степени потери полезной энергии при её преобразовании. Поэтому уменьшение производства энтропии приводит к улучшению процесса и повышению показателей его эффективности – повышению КПД, уменьшению энергетических затрат, повышению производительности и т.д., при сохранении остальных показателей неизменными. Кроме того, при помощи балансовых уравнений может быть исследована чувствительность показателей эффективности процесса к производству энтропии или связь между различными характеристиками процесса.
Составление балансовых уравнений.
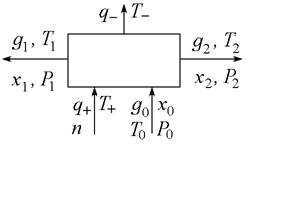 В систему могут поступать вещества конвективно (с потоками) и диффузионно (вследствие диффузии). Обозначим мольный расход веществ в конвективных потоках как
В систему могут поступать вещества конвективно (с потоками) и диффузионно (вследствие диффузии). Обозначим мольный расход веществ в конвективных потоках как 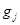 , а в диффузионных как
, а в диффузионных как 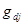 где j - номер потока. Кроме того, в системе могут происходить химические реакции со скоростями
где j - номер потока. Кроме того, в системе могут происходить химические реакции со скоростями  (n=1,2,…), совершаться механическая работа мощностью
(n=1,2,…), совершаться механическая работа мощностью 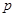 . Потоки тепла, поступающего в систему, обозначим как
. Потоки тепла, поступающего в систему, обозначим как 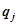 .
.
Рис. 1. Расчетная схема процесса разделения.
Для определённости будем считать потоки положительными, если они входят в систему и отрицательными, если выходят. Работа считается положительной, если совершается системой над окружающей средой.
Приведём общий вид балансовых уравнений.
Материальный баланс.
Обозначим число молей i-того компонента в системе через 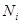 . Изменение числа молей i-того компонента в системе за единицу времени определяется потоками вещества и протекающими в системе химическими реакциями:
. Изменение числа молей i-того компонента в системе за единицу времени определяется потоками вещества и протекающими в системе химическими реакциями:
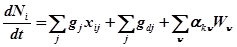
Здесь 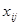 - мольная доля i-того компонента в j-том потоке,
- мольная доля i-того компонента в j-том потоке, 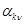 - стехиометрический коэффициент, с которым k-тый компонент входит в уравнение n-той реакции (
- стехиометрический коэффициент, с которым k-тый компонент входит в уравнение n-той реакции ( 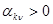 для расходующихся веществ),
для расходующихся веществ), 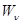 - скорость n-той реакции.
- скорость n-той реакции.
Энергетический баланс.
Изменение энергии системы 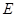 за единицу времени определяется потоками энергии вносимой и уносимой вместе с конвекционными потоками вещества, изменением энергии за счёт диффузионного обмена веществом, потоками тепла (за счёт теплопроводности, переноса излучением, хим. реакции):
за единицу времени определяется потоками энергии вносимой и уносимой вместе с конвекционными потоками вещества, изменением энергии за счёт диффузионного обмена веществом, потоками тепла (за счёт теплопроводности, переноса излучением, хим. реакции):
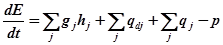
Здесь: 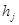 - удельная энтальпия j-того материального потока,
- удельная энтальпия j-того материального потока, 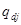 - поток энергии, приносимый вместе с молем вещества, поступающего диффузно.
- поток энергии, приносимый вместе с молем вещества, поступающего диффузно.
Энтропийный баланс.
Изменение энтропии системы S происходит вследствие притока энтропии вместе с веществами, поступающими конвективно и диффузионно, притока и отвода тепла и производства энтропии 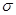 вследствие неравновесности процессов, происходящих внутри самой системы:
вследствие неравновесности процессов, происходящих внутри самой системы:
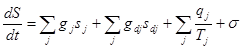 ,
,
где 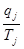 - изменение энтропии под влиянием j-того потока тепла с температурой
- изменение энтропии под влиянием j-того потока тепла с температурой 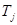 .
.
Производство энтропии (диссипация энергии) заведомо неотрицательно. Отметим, что если рассматривается стационарный режим процесса, когда 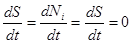 , то эти уравнения из дифференциальных превращаются в алгебраические.
, то эти уравнения из дифференциальных превращаются в алгебраические.
При рассмотрении циклического процесса балансы можно записать не для каждого момента времени, а за цикл работы установки. Так как в начале и конце цикла состояние системы одинаково, то общее изменение энергии, количества вещества и энтропии за цикл равно нулю. Балансы в этом случае также сводятся к системе соотношений, связывающих средние за цикл значения слагаемых, стоящих в правых частях уравнений.
Для закрытых систем, состоящих из нескольких равновесных подсистем, термодинамические балансы имеют форму
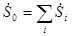 ;
; 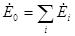 ;
; 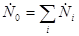
где i - номер подсистемы, а индекс «0» относится к системе в целом. В свою очередь 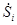 ,
, 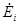 ,
, 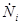 определяются соотношениями термодинамических балансов.
определяются соотношениями термодинамических балансов.
Производство энтропии в различных типовых процессах
Поскольку в балансовые уравнения входит производство энтропии, то, исходя из них, можно получить выражения, позволяющие рассчитать производство энтропии. Рассмотрим несколько конкретных примеров выражений для производства энтропии в стационарном режиме.
Статический режим обмена между двумя термодинамическими подсистемами возможен, если в процессе обмена интенсивные переменные подсистем неизменны.
Подсистемы, интенсивные переменные которых не изменяются при обмене веществом и энергией, называются термодинамическими резервуарами (источниками бесконечной ёмкости). Каждая из подсистем является равновесной. Именно такие системы будут рассмотрены ниже. Везде предполагается, что смеси веществ представляют собой идеальные растворы. Давление (если специально не оговорено иное) в ходе взаимодействия не изменяется и во всех взаимодействующих подсистемах одинаково.
Теплообмен.
Пусть происходит обмен теплом между двумя резервуарами с температурами 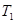 и
и 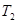 (рис. 2).
(рис. 2).
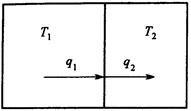
Рис.2. Схема потоков в процессе теплообмена
Энергетический и энтропийный балансы в этом случае имеют вид:
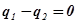 ,
, 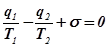 .
.
Отсюда получим выражение для производства энтропии:
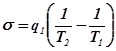
Изотермический массообмен
Пусть два резервуара обмениваются потоками вещества, состоящего из нескольких компонентов. Векторы химических потенциалов в подсистемах равны 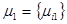 и
и 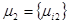 (рис.3).
(рис.3).
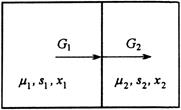
Рис.3. Схема потоков в процессе изотермического массобмена
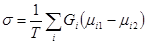
Неизотермический массообмен
Подсистемы обмениваются компонентами, причём температуры подсистем различаются (рис.4).
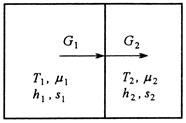
Рис.4. Схема потоков в процессе неизотермического массобмена
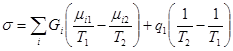 ,
,
где 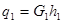 - приток энергии с потоком подводимого вещества.
- приток энергии с потоком подводимого вещества.
Изотермический химический процесс
Пусть в открытой подсистеме при постоянной температуре происходит несколько химических реакций вида
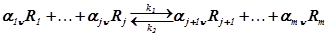 ,
,
со скоростями 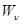 . Для поддержания стационарного режима исходные вещества подаются в подсистему, а получаемые отводятся в требуемых количествах равновесно, т.е. при тех же значениях химических потенциалов (рис.5).
. Для поддержания стационарного режима исходные вещества подаются в подсистему, а получаемые отводятся в требуемых количествах равновесно, т.е. при тех же значениях химических потенциалов (рис.5).
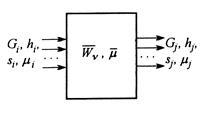
Рис.5. Схема потоков в системе с химическими превращениями
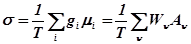 ,
,
где 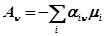 - химическое сродство n-той химической реакции.
- химическое сродство n-той химической реакции.
Тепломассообмен с химическими превращениями
Пусть к подсистеме подводятся тепло от источника с температурой 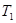 и исходные вещества при температуре
и исходные вещества при температуре 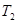 , а отводятся продукты реакции при температуре подсистемы
, а отводятся продукты реакции при температуре подсистемы 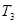 (рис.6).
(рис.6).
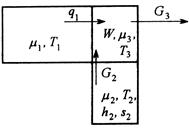
Рис.6. Схема потоков в процессе тепломассообмена с химическими превращениями
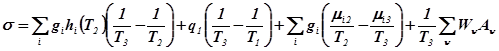
Необходимо определить условия организации процесса на каждой из его стадий, когда при заданной интенсивности процесса минимизируется количество производимой энтропии, нахождение минимально возможных значений производства энтропии и соответствующих им функций изменения параметров процесса (концентраций, температур, давлений).
Поскольку производство энтропии обладает свойством аддитивности, то для процесса, идущего в несколько стадий, общее производство энтропии равно сумме производства энтропии на каждой из стадий. Для каждой стадии находят минимальное производство энтропии при тех или иных условиях, внешних для данной стадии. Суммируя найденные значения и оптимальным образом подбирая условия на границах стадий, получим минимально-возможное количество произведённой энтропии 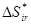 во всём процессе в целом.
во всём процессе в целом.
Определение предельно возможных значений показателей эффективности. Оценка степени термодинамического совершенства организации процесса.
Подставив в уравнения балансов минимально возможное количество произведённой энтропии 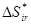 , можно найти предельные значения традиционных показателей эффективности.
, можно найти предельные значения традиционных показателей эффективности.
Отношение минимально возможного (при заданной интенсивности процесса) количества производимой энтропии 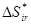 к фактическому (производимому в реальном процессе)
к фактическому (производимому в реальном процессе) 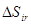 определяет коэффициент термодинамического совершенства организации процесса
определяет коэффициент термодинамического совершенства организации процесса
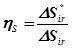 .
.
Отношение предельно-возможного значения обычного показателя эффективности процесса (энергетических и сырьевых затрат, производительности и т.д.) 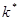 к фактическому
к фактическому 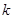
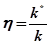 ,
,
также может использоваться для оценки степени совершенства организации процесса. Это позволяет оценить возможность и целесообразность его дальнейшего улучшения.
Также можно сравнить изменение температуры, концентрации, давления в режиме, при котором минимизируется производимая энтропия, с их фактическим изменением в реальном процессе. В ряде случаев это позволяет выявить новые способы совершенствования организации процесса (путём изменения конструкции аппаратов, добавления новых точек подвода или отвода веществ, и т.п.).
Если параметры одной подсистемы меняются, как следует изменять параметры другой, чтобы обеспечить максимальную среднюю интенсивность целевого потока (если ставится задача о предельной производительности, а не о предельной экономичности при заданной производительности)?
|
из
5.00
|
Обсуждение в статье: Термодинамическое описание систем разделения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

