 |
Главная |
Физико-химические основы действия ПАВ
|
из
5.00
|
Снижение вязкости растворов мелассы с помощью моноглицеридов дистиллированных
Введение
Общий рост производства сахара в России обеспечивается за счет переработки сахара сырца, а удельный вес белого сахара, вырабатываемого из сахарной свеклы, к общему объему производству значительно снизился.
Дальнейший спад производства сахара из свеклы приведет к потере отечественной сахарной промышленности. Для сохранения и развития сахарной промышленности необходимо создать условия для обновления и модернизации свеклосахарного комплекса, внедрять новые технологии для усовершенствования всего сахарного производства.
Одним из направлений повышения выхода и улучшения качества сахара-песка является использование в технологии производства сахара различных химических веществ, в частности поверхностно-активных веществ (ПАВ).
Среди большого количества отечественных ПАВ, используемых в различных отраслях, обращает на себя внимание класс пищевых ПАВ. В их числе неполные эфиры жирных кислот и глицерина, широко используемые в пищевой промышленности. Пищевые ПАВ безвредны и способствуют лучшему усваиванию пищи организмом.
Литературный обзор
Выход и качество сахара-песка в значительной степени зависят от правильного проведения процессов кристаллизации сахара и центрифугирования утфелей. Для улучшения и интенсификации проведения технологических процессов применяют поверхностно-активные вещества (ПАВ). Наибольший эффект от применения пищевых ПАВ достигается при переработке сырья ухудшенного качества, в процессах получения и центрифугирования утфелей II и III кристаллизаций.
Поверхностно-активные вещества в сахарном производстве способствуют решению важных технологических задач:
- снижение вспенивания;
- уменьшение вязкости сахарсодержащих растворов;
- улучшение процессов получения и центрифугирования утфелей.
Поверхностно-активные вещества (ПАВ). Классификация. Свойства. Строение молекул
ПАВ представляют собой обширную группу соединений, различных по своей структуре, относящихся к разным классам. Эти вещества способны адсорбироваться на поверхности раздела фаз и понижать вследствие этого поверхностную энергию (поверхностное натяжение).
ПАВ классифицируется по двум основным признакам: химическому строению и механизму молекулярного воздействия.
По химическому строению.
В зависимости от свойств, проявляемых ПАВ при растворении в воде, их делят на анионоактивные вещества (активной частью молекул является анион); катионактивные вещества (активной частью молекул является катион); амфолитные; неионогенные, которые совсем не ионизируются.
Анионоактивные ПАВ в водном растворе ионизируются с образованием отрицательно заряженных органических ионов. Из анионоактивных ПАВ широкое применение нашли соли сернокислых эфиров (сульфиты) и соли сульфокислот (сульфонаты). Радикал может быть алкильным, алкиларильным, алкилнафтильным, иметь двойные связи и функциональные группы.
Катионактивные ПАВ – вещества, которые ионизируются в водном растворе с образованием положительно заряженных органических ионов. К ним относятся четвертичные аммониевые соли, состоящие из углеводородного радикала с прямой цепью, содержащей 12-18 атомов углерода; метильного, этиьного или бензильного радикала; хлора, брома, иода или остатка метил- или этилсульфата.
Амфолитные ПАВ ионизируются в водном растворе различным образом в зависимости от условий среды: в кислом растворе проявляют катионактивные свойства, а в щелочной – анионоактивные.
Неионогенные ПАВ представляют собой высокомолекулярные соединения, которые в водном растворе не образуют ионов.
В мировом производстве ПАВ большую часть составляют анионные вещества. Среди них можно выделить карбоновые кислоты, а также их соли, алкилсульфаты (сульфоэфиры), алкилсульфонаты и алкил-арилсульфонаты. Наиболее распостранены натриевые и калиевые мыла жирных и смоляных кислот, нейтрализованные продукты сульфирования высших жирных кислот, олефинов, алкилбензолов.
Второе место по объему промышленного производства занимают неионные ПАВ – эфиры полиэтиленгликолей. Большинство неионных ПАВ получают присоединением окиси этилена к алифатическим спиртам, алкилфенолам, карбоновым кислотам, аминам и др. соединениям с реакционноспособным атомом водорода. Ассортимент ПАВ чрезвычайно велик. Приведенные ниже данные позволяют видеть соотношение объемов производства ПАВ различных типов.
Таблица 1
Соотношение объемов производства ПАВ различных типов
| Поверхностно-активные вещества | тыс. т. | % |
| Анионные Неионные Катионные и пр. | 2480 1160 360 | 62 29 9 |
| Всего: | 4000 | 100 |
Мировое производство ПАВ постоянно возрастает, причем доля неионных и катионных веществ в общем выпуске все время увеличивается. В зависимости от назначения и химического состава ПАВ выпускают в виде твердых продуктов (кусков, хлопьев, гранул, порошков), жидкостей и полужидких веществ (паст,гелей).
Особое внимание все больше и больше уделяется производству ПАВ с линейным строением молекул, которые легко подвергаются биохимическому разложению в природных условиях и не загрязняют окружающую среду.
По механизму молекулярного действия (делятся на четыре группы).
К первой относятся вещества, которые активны на границе жидкость-газ и вода-воздух. Эти соединения не образовывают коллоидных структур и относятся к низкомолекулярным веществам, растворимым в воде. Например спирты понижают поверхностное натяжение воды при 20 оС с 72,8 до 30-50 эрг/см2. Используют такие ПАВ как пеногасители, вытесняющие менее поверхностно-активные стабилизаторы пены.
Ко второй группе принадлежат вещества, активные на границе двух несмешивающихся жидкостей или на границе твердых поверхностей раздела. Они не образуют структур ни в объеме раствора, ни в поверхностных слоях. Понижая свободную поверхностную энергию жидкости или твердого тела в результате адсорбции, ПАВ второй группы облегчают процесс образования новых поверхностей, т.е. диспергирования в данной среде.
К третьей группе относятся вещества, которые дают гелеобразную структуру, как в адсорбционном слое, так и в растворе; они являются сильными стабилизаторами суспензий – предотвращают коагуляцию частиц, их агрегирование при любом содержании твердой дисперсионной фазы, обеспечивая ее равномерное распределение в окружающей среде. Стабилизаторы не только препятствуют обычной коагуляции частиц, но и предотвращают развитие коагуляционных структур. Адсорбируясь на поверхности, они блокируют места сцепления частиц, препятствуя их сближению; разрушается пространственная сетка, что позволяет уменьшить количество воды для среды без изменения текучести системы.
ПАВ как стабилизаторы, так и не обладающие стабилизирующим действием, могут модифицировать зарождение и рост кристаллов новой фазы. Прежде всего, они замедляют развитие возникающих центров кристаллизации, образуют на их поверхности адсорбционные слои. Избирательная абсорбция, различная на разных гранях развивающегося кристалла, резко изменяет форму кристалла, часто способствует развитию поверхности, т.е. превращение симметричных форм в анизометричные тонкие пластинки.
Четвертая группа ПАВ – моющие средства. Они сильно понижают поверхностное натяжение воды на границе с воздухом. Моющие вещества, как правило, являются не только диспергаторами, но и стабилизаторами и эмульгаторами.
По биохимической устойчивости.
ПАВ делят на мягкие, промежуточные и жесткие с константами скорости биохимического окисления, соответственно не менее 0,3 сутки-1; 0,3-0,05 сутки-1; менее 0,05 сутки-1.
К числу наиболее легко окисляющихся ПАВ относятся первичные и вторичные алкилсульфаты нормального строения. С увеличением разветвления цепи скорость окисления понижается, и наиболее трудно разрушаются алкилбензол-сульфонаты, приготовленные на основе тетрамеров пропилена.
При понижении температуры скорость окисления ПАВ уменьшается и при 0-5оС протекает весьма медленно. Наиболее благоприятные для процесса самоочищения от ПАВ нейтральная или слабощелочная среды (pH 7-9).
Максимальные количества кислорода (БПК), потребляемые 1 мг/дм3 различных ПАВ колеблется от 0 до 1,6 мг/дм3. При биохимическом окислении ПАВ образуются различные промежуточные продукты распада: спирты, альдегиды, органические кислоты и др. В результате распада ПАВ, содержащих бензольное кольцо, образуются фенолы.
Полярные и неполярные группы ПАВ.
Примером полярных групп могут служить –OH, -COOH, -NO2, -NH2, -CN, -OSO3 и т.д. Неполярной частью молекулы обычно являются углеродные радикалы. К ПАВ относятся карбоновые кислоты, спирты, амины, сульфокислоты и другие вещества. Условно принято обозначать молекулы ПАВ символом ----О, где кружок соответствует полярной группе, а палочка неполярной.
Типичные ПАВ – органические соединения дифильного строения, т. е. содержащие в молекуле атомные группы, сильно различающиеся по интенсивности взаимодействия с окружающей средой (в наиболее практически важном случае – водой). Так в молекулах ПАВ имеются один или несколько углеводородных радикалов, составляющих липофильную часть (она же гидрофобная часть молекулы), и одна или несколько полярных групп – гидрофильная часть.
Слабо взаимодействующие с водой олеофильные (гидрофобные) группы определяют стремление молекулы к переходу из водной (полярной) среды в углеводородную (неполярную). Гидрофильные группы, наоборот, удерживают молекулу в полярной среде или, если молекула ПАВ находится в углеводородной жидкости, определяют ее стремление к переходу в полярную среду. Таким образом, поверхностная активность ПАВ, растворенных в неполярных жидкостях, обусловлена гидрофильными группами, а растворенных в воде – гидрофобными радикалами.
Все ПАВ можно разделить на две категории по типу систем, образуемых ими при взаимодействии с растворяющей средой. К одной категории относятся мицеллообразующие ПАВ, к другой – не образующие мицелл. В растворах мицеллообразующих ПАВ выше критической концентрации мицеллообразования (ККМ) возникают коллоидные частицы (мицеллы), состоящие из десятков или сотен молекул (ионов).
Мицеллы обратимо распадаются на отдельные молекулы или ионы при разбавлении раствора (точнее, коллоидной дисперсии) до концентрации ниже ККМ. Таким образом, растворы мицеллообразующих ПАВ занимают промежуточное положение между истинными (молекулярными) и коллоидными растворами (золями), поэтому их часто называют полуколлоидными системами. К мицеллообразующим ПАВ относятся все моющие вещества, эмульгаторы, смачиватели, диспергаторы и др.
Нормы добавления ПАВ
Любое вещество в виде компонента жидкого раствора или газа (пара) при соответствующих условиях может проявить поверхностную активность, т.е. адсорбироваться под действием межмолекулярных сил на той или иной поверхности, понижая ее свободную энергию. Однако поверхностно - активными обычно называются лишь те вещества, адсорбция которых из растворов уже при весьма малых концентрациях (десятые и сотые доли процента) приводит к резкому снижению поверхностного натяжения, т.е. существует оптимальная величина добавки ПАВ. Следует отметить, что количество ПАВ не должно превышать установленных норм, так как может наступить критическое состояние, при котором образуются мицеллы, - критическая концентрация мицеллообразования. Мицеллы представляют собой новую коллоидную форму. Они возникают в результате сцепления углеводородных цепей. При увеличении концентрации ПАВ, мицеллы становятся цилиндрическими или эллипсоидальными, пока не превращаются в слоистые мицеллы. Это превращение сопровождается резким повышением вязкости раствора. Поверхностная активность веществ зависит не только от их природы, но и от природы растворителя. Так, все вышеуказанные ПАВ обладают поверхностной активностью на границе вода – воздух, но являются инактивными по отношению к поверхности фаз органические растворители – воздух.
|
|
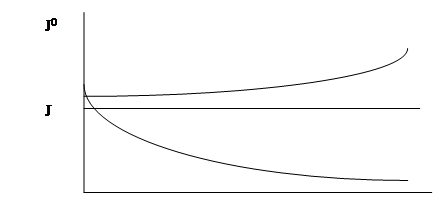
Рис. 1. Влияние поверхностно-инактивного (1) и поверхностно-активного (2) веществ на поверхностное натяжение:
Молекулы ПАВ адсорбируются на поверхности раздела фаз, снижая тем самым J поверхностное натяжение. Адсорбция ПАВ происходит по следующей причине. Взаимодействие между диполями воды значительно сильнее, чем между диполями и неполярными частями ПАВ. Поэтому энергетически выгоден переход молекул ПАВ из фазы на поверхность или в другую фазу, при этом восстанавливаются сильные диполь-дипольные и водородные связи молекул воды. Чем длиннее углеводородный радикал, там больше молекул воды он разобщает и тем больше тенденция выхода молекул ПАВ на поверхность, т.е. тем больше их адсорбция. Эффект снижения поверхностного натяжения растворов с ПАВ может быть очень велик.
С ростом концентрации ПАВ в растворе поверхностное натяжение сначала падает резко, а затем – постепенно, подобный ход кривой объясняется тем, что при малых концентрациях поверхность жидкости свободна и практически все растворенные молекулы ПАВ адсорбируются на поверхности воды, сильно снижая поверхностное натяжение. При больших концентрациях на поверхности образуется насыщенный мономолекулярный слой молекул ПАВ, дальнейшая адсорбция становится невозможной и с ростом концентрации поверхностное натяжение изменяется незначительно. Поверхностное натяжение растворов при этих концентрациях приближается к значению поверхностного натяжения самих ПАВ на границе с воздухом.
Физико-химические основы действия ПАВ
Поверхностно-активными веществами (ПАВ) являются химические соединения, которые способны адсорбироваться на границе раздела фаз. Адсорбируясь в виде тончайшего (мономолекулярного) слоя, ПАВ могут резко изменять молекулярное взаимодействие соприкасающихся фаз, вследствие чего меняются скорости обмена веществ между фазами: скорости испарения, растворения, конденсации, кристаллизации. Причем эти изменения происходят под влиянием ничтожно малых количеств ПАВ, что определяют их высокую технико-экономическую эффективность.
Поверхностная активность зависит от природы растворяемого вещества.
При растворении в воде неорганические электролиты являются поверхностно-инактивными по отношению к воде, т.е. несколько превышают поверхностное натяжение чистой воды. Поэтому в водных растворах инактивных веществ, которыми могут являться обычные соли, воду необходимо рассматривать как ПАВ. На границе же жидкости и твердого тела электролиты могут адсорбироваться положительно, т.е. оказываться ПАВ.
Поверхностно-активными веществами в водных растворах на границе раздела с воздухом или собственным паром являются органические вещества, молекулы которых состоят из ассиметрично расположенных полярной группы и углеводородного радикала (спирты, амины, фенолы, карбоновые кислоты и др.), а также их щелочные соли.
Решающее значение для оценки поверхностно-активных свойств веществ имеет баланс между полярной группой и углеводородным неполярным радикалом.
Чем длиннее углеводородная цепь и чем менее гидрофильна полярная группа ПАВ, тем выше его поверхностная активность.
По правилу Дюкло-Траубе поверхностная активность возрастает с ростом длины цепи в 3-3,5 раза при переходе к каждому последующему гомологу на I звено -CH2-. Сокращение длины углеводородной цепи при той же полярной группе, т.е. переход от высших членов данного гомологического ряда к низшим, вызывает резкое усиление растворимости в воде: низшие гомологи (от С1 до С4) неограниченно растворимы в воде; высшие (от С11 и выше) – практически нерастворимы.
Некоторые исследователи считают, что, уменьшая симметрию молекулы в целом, используя разветвленную гидрофобную цепь или заменяя двумя короткими одну длинную, можно повысить концентрацию ПАВ в слое и еще более понизить поверхностное натяжение без образования мицелл.
В водных растворах адсорбция в поверхностном слое, в отличие от адсорбции на твердой поверхности, сводится к выталкиванию углеводородных цепей и циклов из водной среды вследствие сильного притяжения молекул воды друг к другу. При небольшой концентрации молекулы ПАВ ориентируются в адсорбционном слое горизонтально с «утопленной» в воду полярной группой и «плавающей» на воде цепью. По мере увеличения концентрации и заполнения адсорбционного слоя углеводородные цепи ориентируются вертикально. Такая ориентация молекул ПАВ соответствует минимуму свободной энергии системы. При дальнейшем повышении концентрации Пав в водном растворе может наступить критическое состояние, при котором образуются мицеллы, - критическая концентрация мицеллообразования (ККМ).
Мицеллы представляют собой новую коллоидную форму. Они возникают в результате сцепления вандер-ваальсовыми силами углеводородных цепей, образующих неполярное ядро с гидрофильной оболочкой из полярных групп. При концентрации, например, мылоподобного ПАВ в водном растворе выше
ККМ вначале возникают сфероидальные мицеллы с оболочками из гидратированных полярных групп и ядром из углеводородных цепей. В дальнейшем, при увеличении концентрации ПАВ, такие мицеллы становятся все более ассиметричными – цилиндрические или эллипсоидальными, пока не превращаются в слоистые мицеллы. Это превращение сопровождается резким повышением вязкости раствора, особенно при самых малых градиентах скорости. Специальными опытами показано, что предельная вязкость молярного водного раствора олеата натрия падает в сотни тысяч раз под влиянием солюбилизации (коллоидного растворения) в мицеллах какого-либо углеводорода. Таким образом, в результате солюбилизации слоистые мицеллы распадаются, превращаясь в сфероидальные меньшего размера. Этим доказывается тесная связь между поверхностными и объемными свойствами растворов ПАВ.
Изотермы поверхностного натяжения и изотермы адсорбции ПАВ на поверхности жидкость-газ.
В 1908 г. Шишковский провел исследование зависимости поверхностного натяжения водных растворов низших жирных кислот (углеводородная цепь из 3-6 групп –СН2–) от их концентрации С.
Результаты его опытов:
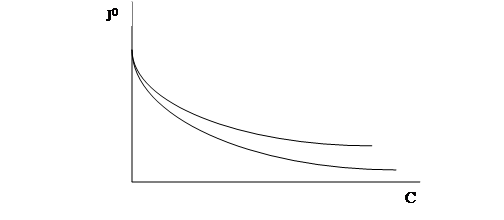
Рис. 2. Зависимость поверхностного натяжения водных растворов низших жирных кислот от их концентрации.
Шишковский установил, что полученные данные могут быть описаны эмпирическим уравнением (уравнение Шишковского):

где J0 – поверхностное натяжение чистой воды,
С – концентрация ПАВ,
А и В – константы уравнения.
Оказалось, что А остается постоянной для всех членов гомологического ряда, а В увеличивается в 3-3,5 раза при удлинении углеводородной цепи на одно звено –СН2–.
Графически дифференцируя кривые, полученные Шишковским, а также используя собственные данные, Ленгмюр рассчитал по уравнению Гиббса изотермы адсорбции исследованных ПАВ.
При одинаковой концентрации адсорбция ПАВ тем больше, чем длиннее углеводородная цепь, но для всех членов гомологического ряда кривые стремятся к одному и тому же пределу Г, называемому предельной адсорбцией или емкостью монослоя.
|
из
5.00
|
Обсуждение в статье: Физико-химические основы действия ПАВ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

