 |
Главная |
Теплота испарения воды
|
из
5.00
|
Теплота испарения (теплота парообразования) (LИСП,) - количество теплоты, которое необходимо сообщить веществу в равновесном изобарно-изотермическом процессе, чтобы перевести его из жидкого состояния в газообразное (в пар) (то же количество теплоты выделяется при конденсации пара в жидкость).
Различают удельную теплоту испарения (измеряется в Дж/г, ккал/кг) и мольную (молярную) теплоту испарения (Дж/моль).
Удельная теплота парообразования воды при нормальном внешнем давлении (760 мм рт. ст., или 101325 Па) и температуре кипения - 539 кал/г, или 22,6⋅105 Дж/кг, почти в 6,8 раз выше, чем теплота плавления. Чтобы превратить жидкую воду с температурой 100°С в пар с такой же температурой, нужно затратить поистине гигантскую энергию, в то время как около 1/3 этой энергии вполне достаточно, чтобы превратить в пар этиловый спирт, и 1/8, чтобы жидкую ртуть сделать парообразной.
Что же касается теплоты парообразования воды, то тут аномальности не наблюдается. Чем холоднее жидкая вода, тем больший приток теплоты нужен, чтобы обратить её в пар. Так, при 0 °С теплота парообразования воды 587, при 50 °С - 568, при 100 °С - 536, при 150 °С - 446 кал/г.
Поверхностое натяжение и адгезия воды
Поверхностное натяжение - стремление жидкости вести себя так, как будто она покрыта плёнкой, возникающей из-за притяжения между поверхностными молекулами. Благодаря поверхностному натяжению изолированная капля воды занимает наименьшее возможное пространство, обычно принимая форму шара.
Поверхностное натяжение - это поверхностная энергия, отнесённая к единице поверхности:
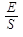
σ = ,
где σ - поверхностное натяжение, Дж/м2 или н/м;
E – поверхностная энергия;
S – площадь поверхности.
Поверхностное натяжение - это способность пограничных молекул воды, а также твёрдых тел сцепляться, "стягиваться", самоуплотняться (когезия[24]).На поверхности воды сцепления молекул создают плёнку натяжения, для разрыва которой требуется немалая сила. На этой плёнке могут лежать, не погружаясь в воду, предметы, которые в 8 и более раз тяжелее воды, например лезвие безопасной бритвы, иголка, монетка и др. Поверхностное натяжение воды при 18 °С составляет 72 дин/см - это очень высокое значение (сравните: для этилового спирта оно составляет 22, для ацетона 24, для бензина 29 дин/см). Только ртуть имеет ещё более высокое поверхностное натяжение - 484 дин/см, при комнатой температуре.
Рассчитано, что для разрыва столбика чистой воды диаметром 2,5 см потребуется приложить усилие 931 кН. Поскольку совершенно чистой воды в природе нет, да и в лабораторных условиях получить её невозможно, то в условиях эксперимента для разрыва столбика воды сечением 0,65 см2 требуется усилие в пределах "только" 9,8 кН[25] что близко к прочности стали.
У воды есть и ещё одно удивительное свойство - адгезия[26], которое можно наблюдать в узких стеклянных трубках (капиллярах), где вода поднимается вверх вопреки силам притяжения (гравитации). В таких трубках сочетаются силы сцепления молекул воды в пограничном с воздухом слое со способностью воды смачивать стекло, «прилипать» к нему. В результате в капилляре образуется вогнутая поверхность выше естественного уровня воды. У ртути, обладающей более высоким поверхностным натяжением, адгезия отсутствует, поэтому ртуть в капиллярной трубке имеет не вогнутую, а выпуклую поверхность. К поверхностям, покрытым жировым слоем, например парафином, вода не прилипает и мениск [27] её в капилляре подобно мениску ртути, будет не вогнутый, а выпуклый.
Существует понятие капиллярной постоянной, которая равна произведению высоты подъёма жидкости на радиус капилляра. Капиллярная постоянная для чистой воды линеино уменьшается с увеличением температуры, а при достижении критической температуры становится равной нулю. Предельная высота капиллярного подъёма воды при 15 °С составит в крупном песке около 2 м, в мелком 1,2 м, а в чистой глине 12 м, причём продолжительность подъёма для крупных капилляров - 5-10 суток, а для мелких до 16 месяцев.
Теплоёмкость воды
Теплоёмкость - количество теплоты, поглощаемой телом при нагревании на 1 градус (1 °С или 1 К); точнее - отношение количества теплоты, поглощаемой телом при бесконечно малом изменении его температуры, к этому изменению.
Теплоёмкость единицы массы вещества (г, кг) называется удельной теплоёмкостью, 1 моля вещества - мольной (молярной) теплоёмкостью.
Единицами теплоёмкости служат Дж/(кг ∙ К), Дж/(моль ∙ К), Дж/(м3∙К) и внесистемная единица кал/(моль ∙ К).
Теплоёмкость воды (Cp) при атмосферном давлении и при температуре 25 °С равна 4,18 кДж/(кг ∙ К) и сама по себе она не аномальна, но в 1,7-30 раз выше, чем у других жидких веществ.
Сравните: теплоёмкость ртути - 0,139, бензола - 1,35, серной кислоты - 1,40, ацетона - 2,16, этилового спирта - 2,42 кДж/(кг ∙ К)
Теплоёмкость, большинства твёрдых веществ (металлы, графит, соль, NaCl, гранит, песок, бетон, известняе) меньше 1, за исключением некоторых веществ, например древесина и текстолита [28], теплоёмкость которых соответственно равна ~1,3 и ~1,47 кДж/(кг ∙ К).
У всех веществ, кроме ртути и жидкой воды, удельная теплоёмкость с повышением температуры возрастает. У воды же удельная теплоёмкость в интервале температур от 0 до 35 °С уменьшается, а затем начинает увеличиваться.
Удельная теплоёмкость воды при 160С принята за единицу и служит эталоном меры для других веществ. Как и плотность, удельная теплоёмкость воды в зависимости от температуры не однозначна, а двузначна. Например, при 25 и 50 °С она одинакова - 0,99800 кал/(г ∙ °С). Теплоёмкость льда в интервале от 0 до -20 °С в среднем 0,5 кал/(г ∙ °С), то есть в два раза меньше, чем у жидкой воды. Удельная теплоёмкость спирта и глицерина - 0,3 (в три раза меньше, чем у воды), железа - 0,1, платины - 0,03, древесины - 0,6, каменной соли (NaCl) и песка - 0,2 кал/(г ∙ °С). В связи со сказанным выше становится понятным, почему при одинаковом получении солнечного тепла вода в водоёме нагреется в 5 раз меньше, чем сухая песчаная почва на берегу, но при этом вода во столько же раз дольше будет сохранять теплоту, нежели песок. Любопытно, что теплоёмкость воды в переохлаждённом состоянии (например, при -7,5 °С) на 2 % выше, чем при той же температуре, но уже в кристаллическом состоянии.
|
из
5.00
|
Обсуждение в статье: Теплота испарения воды |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

