 |
Главная |
Способы выражения концентрации растворов
|
из
5.00
|
Концентрация1 - это количественное содержание компонентов в растворе, массовое или объёмное количество растворенного вещества в объёме или массе раствора (л или кг).
Ниже привидены наиболее распространённые способы выражения концентрации
растворов.
1. Массовая доля – отношение массы растворённого вещества к общей массе раствора:
 |
_______________________________
1 Концентрация — сосредоточение, скапливание, собирание кого -либо, чего-либо в каком-либо месте.
_______________________________
Молярная концентрация (молярность) показывает число молей растворённого вещества, содержащееся в 1 л раствора:
 |  | ||
где V — объём раствора (в л);
n – число молей растворённого вещества.
Молярная концентрация выражается в моль/л. Эта размерность иногда обозначается М, например: 2 М NaOH.
Молярная концентрация эквивалента — отношение количества вещества эквивалента к объёму раствора:

Пример. Пусть в 100 г раствора находится 1 г KСl, тогда ɷ(KCl)=0,01 (или 1%). Такой раствор называют однопроцентным. Следовательно, для приготовления 100 г 1 %го водного раствора KСl надо взять 1 г этой соли и 99 г Н2О.
2. Молярная концентрация раствора (молярность) - отношением количества вещества, содержащегося в растворе, к объёму этого раствора:

где М(В) — молярная масса растворённого вещества, г/моль.
Единица молярной концентрации — моль/л.
Вместо обозначения моль/л допускается обозначением М.
Пример: 2 М NaOH; 0,5 M HCl.
Пример. Пусть в 1 л раствора содержится 1 моль Квт, тогда C(KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1 М. Аналогично концентрации 0,1 М, 0,01 М и 0,001М означают деци-, санти- и миллимолярный раствор.
3. Молярная концентрация эквивалента вещества (нормальность) — это отношение числа эквивалентов растворённого вещества, к объёму раствора:
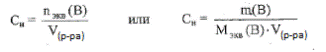 |
где Мэкв(В) — эквивалентная масса растворённого вещества г/моль.
Единица молярной концентрации эквивалента - моль/л.
Обозначается через н. или N.
Пример : 1 н. р-р НС1 или 1 N р-р КОН.
Показатели качества воды
Цветность воды
Показатель, характеризующий наличие веществ, вызывающих окрашивание воды, называется окраской воды .
Показатель, характеризующий интенсивность окраски воды, называется цветностью воды .
Цветность воды рекомендуется определять измерением её оптической плотности на спектрофотометре при различных длинах волн проходящего света.
При определении окраски воды пробы не консервируются. Определение проводят через 2 ч после отбора пробы.
Исследуемую воду предварительно фильтруют, отбрасывая первые порции фильтрата.
Оптическую плотность измеряют при толщине слоя 10 см, вторую кювету прибора заполняют дистиллированной водой. Длина волны света, максимально поглощаемого водой, является характеристикой её цвета. Если на полученной кривой имеется несколько пиков, то соответствующие им длины волн должны быть отмечены.
Следует учитывать, что видимый цвет раствора всегда является дополнительным к цвету поглощаемого электромагнитного излучения.
Таблица 6
Интервалы длин волн поглощаемого излучения и соответствующие цвета
| Интервалы длин волн поглощаемого излучения, нм у а -евета, нм | Цвет поглощаемого излучения | Дополнительный (видимый) цвет |
| 400-450 | Фиолетовый | Жёлто-зелёный |
| 450-480 | Синий | Жёлтый |
| 480-490 | Зелёно-синий | Оранжевый |
| 490-500 | Сине-зелёный | Красный |
| 500-560 | Зелёный | Пурпурный |
| 560-575 | Жёлто-зелёный | Фиолетовый |
| 575-590 | Жёлтый | Синий |
| 590-605 | Оранжевый | Зелёно-синий |
| 605-730 | Красный | Сине-зелёный |
| 730-760 | Пурпурный | Зелёный |
Значение оптической плотности исследуемой воды при длине волны, близкой к максимуму поглощения, является мерой интенсивности её окраски.
Спектрофотометр может быть заменён фотометром (типа Пульфриха) или электрофотоколориметром при наличии достаточного числа светофильтров, пропускающих узкие полосы спектра света. В отсутствие приборов цветность сточной воды приходится определять визуальным наблюдением: светло-жёлтая, пурпурно-красная и т. п.
Требования для спуска сточных вод в водоём регламентируют, чтобы вода в водоёме после смешения её со сточной водой не имела видимой окраски при толщине слоя 10 см. Поэтому практическое имеет определение степени разбавления сточной воды, при которой цвет её при указанной толщине слоя перестаёт различаться. Для этого помещают на лист бумаги три цилиндра (диаметром 20-25 мм) из бесцветного стекла. В первый цилиндр наливают исследуемую сточную воду (высота слоя 10 см), в третий - такое же количество дистиллированной воды; во второй цилиндр наливают в таком же объёме разбавленную сточную воду, увеличивая каждый раз степень разбавления (1 : 1, 1 : 2, 1 : 3 и т. д.), пока при просматривании сверху через воду во втором и третьем цилиндрах бумага не будет выглядеть одинаково белой.
Цветность - воды во многом обусловлено цветение м воды — массовым развитием фитопланктона, вызывающим изменение окраски воды.
Запах воды
Качественное определение запаха проводят как при комнатной температуре, так и при нагревании до 50—65 °С в колбе, покрытой часовым стеклом. Результат определения запаха выражают описательно: хлорный - запах свободного хлора, землистый - запах влажной почвы, фенольный , запах нефти , аптечный , сероводородный , навозный , затхлый , запах гниющего сена , рыбный , гнилостный и т.д .
Большое значение иногда имеет приближённо-количественное определение запаха. Для определения малых количеств органических веществ ещё не разработаны точные методы. Если эти вещества (как нередко бывает) в очень разбавленных растворах имеют ощутимый запах, то их можно с достаточно малой погрешностью количественно определить путём разбавления испытуемой воды до достижения порога ощущения запаха. Для этого сначала находят пороговую концентрацию определяемого вещества. Приготовляют его раствор точно известной концентрации, который затем разбавляют водой до тех пор, пока не перестанет ощущаться запах. Для разбавления следует применять водопроводную воду, предварительно пропущенную через колонку с активированным углём. Дистиллированную воду применять нельзя, так как она зачастую имеет своеобразный запах.
Кислотность воды
Кислотность является одним из показателей агрессивности воды - способностью воды и растворённых в ней веществ разрушать посредством химического воздействия различные материалы.
Кислотностью называется содержание в воде веществ, вступающих в реакцию с сильными щелочами (едким натром, едким кали), то есть с гидроксид-ионами. К этим веществам относятся:
1) сильные кислоты, полностью диссоциирующие в разбавленных растворах с образованием ионов
водорода: хлороводородная (соляная) НС1, азотная НNО3, серная H2SO4;
2) слабые кислоты: уксусная СН3СООН, сернистая Н2SО3, угольная Н2СО3, сероводородная Н2S и т. п.;
3) катионы органических и слабых неорганических оснований: аммония NН4+, железа Fе2+ и
Fе3+, алюминия Аl3+. Химические соединения, содержащие эти катионы, гидролизуются с образованием
ионов водорода.
В конце титрования веществ второй группы едким натром раствор должен содержать соответствующие этим слабым кислотам анионы, например:
СН3СООН + ОН- = СН3СОO- + Н2О
Н2СО3 + ОН- = НСО3- + Н2О,
которые, гидролизуясь, придают раствору слабощелочную реакцию. Слабощелочная среда создаётся также и при полном превращении некоторых катиошв, входящих в состав третьей группы, в слабые основания. Поэтому для определения общей кислотности воды надо применять индикаторы, цвет которых изменяется в слабощелочной среде (то есть при довольно большом значении рН), или проводить титрование потенциометрическим методом.
Наиболее подходящим индикатором является тимолфталеин, хотя в большинстве случаев можно пользоваться и легкодоступным фенолталеином . У первого окраска появляется при рН 9,4; у второго - при рН < 8,4.
Общая кислотность так же недостаточно характеризует состав воды, как и общая щёлочность. В данном случае, проводя титрование потенциометрически, можно по полученным на кривой титрования точкам перегиба установить содержание в воде различных групп веществ, титруемых едкой щёлочью. Для дальнейших разделений здесь, так же как и при определении щёлочности, можно воспользоваться летучестью некоторых кислот и оснований. Как и при определении щёлочности, потенциометрическое титрование до известной степени может быть заменено титрованием с двумя индикаторами, цвет которых изменяется при различных значениях рН: один - в кислой среде, другой - в щелочной. Аналогично при определении щёлочности могут быть выделены следующие группы веществ, обусловливающие кислотность воды.
|
из
5.00
|
Обсуждение в статье: Способы выражения концентрации растворов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

