 |
Главная |
Водородный показатель равен 1,3.
|
из
5.00
|
Гидроксильный показатель находится из ионного произведения воды:
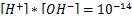
Выражая концентрацию [OH-] из формулы, находим:

Концентрация гидроксид-ионов [OH-] равна 2*10-13 моль/л.
Гидроксильный показатель можно найти двумя путями:
1) исходя из равенства:

2) и через логарифм концентрации гидроксид-ионов:

Преобразуя равенство (5), получаем:


или подставляя концентрацию гидроксид-ионов в формулу (6). находим:

Гндроксильный показатель равен 12,7.
Задача 4.
Чему равен водородный показатель рН, гидроксильный показать
рОН, концентрация ионов водорода [Н+] и концентрация гидроксид-
ионов [ОН-] в 0,77 М растворе ортофосфорной кислоты с константой
диссоциации, равной 1,3.10-12.
Решение. Ортофосфорная кислота Н3РО4 является электролитом средней
силы, но её всё же относят к слабой кислоте. В результате её
диссоциации в растворе одновременно имеются и недиссоциированные
молекулы и ионы, которые находятся в химическом равновесии:

Используя закон действующих масс, равновесие в растворах
слабых электролитов выражается константой диссоциации:

Так как концентрация ионов Н+ и РО43- находятся в равновесии, то
их концентрации равны.
Обозначим концентрацию [РО43-] за х, то концентрацию [Н+] за х3
(так как в результате диссоциации Н3РО4 образуется 3 моль ионов Н+).
Концентрация Н3РО4 по условию равна 0,77 моль/л. Подставим значения
в формулу (7), получим:


Таким образом, концентрация ионов водорода равна 10-3 моль/л.
Водородный показатель найдём по формуле:

Водородный показатель равен 3.
Гидроксильный показатель найдем из ионного произведения воды
формуле . Выражая концентрацию [ОН-] из формулы, находим:

Концентрация гидроксид-ионов [ОН-] равна 10-11 моль/л.
Гидроксильный показатель найдём из формулы:
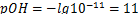
Гндроксильный показатель равен 11.
Задача 5.
Для устранения общей жесткости к 50 л воды добавлено 7,4 г
Са(ОН)2 и 5,3 г Na2C03. Рассчитайте временную, постоянную и общую
жёсткость воды.
Решение. При добавлении к воде Са(ОН)2 можно устранить временную
жёсткость, а добавление Na2C03 - как временную, так и постоянную, в
результате чего происходят следующие реакции:


где М - катион жёсткости.
Постоянную жестокость находим по количеству добавленной к
раствору соды по формуле:
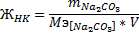
а временную - по добавленной щелочи:

где Мэ – эквивалентная масса, г моль;
m – масса, г
V – объем, л.
Найдем эквивалентную массу соли и основания по формулам:


где М - молярная масса вещества, г/моль;
n - число катионов (анионов) в соли;
z - модуль заряда катиона (аниона) в соли;
nOH- - кислотность основания, число ионов ОН- в формульной единице основания.
По формуле эквивалентная масса соли равна:

По формуле эквивалентная масса основания равна:
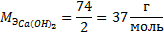
Определим жесткость воды:
1) карбонатная (временная) жёсткость

2) некарбонатная (постоянная) жёсткость

3) общая жесткость воды:

Задача 6.
Общая жесткость воды равна 6,52 ммоль/л, а временная - 3 32
ммоль/л. Какую массу Na2C03 и Са(ОН)2 надо взять для устранения
жесткости 5 л воды ?
Решение. Определим постоянную жёсткость:
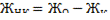

Из формул и выразим массы соды и гашёной извести,
которые необходимо добавить в воду для устранения её жёсткости.


Найдём по формулам и эквивалентные массы соды и
извести:


отсюда

Задача 7.
Рассчитайте общую жёсткость, если в 0,25 л воды содержится 16,20 мг Са(НСО3)2, 2,92 мг Mg(HCО3)2, 11,10 мг СаСl2 и 9,50 мг MgCl3.
Решение. Формула для расчета общей жесткости:

где МЭ – эквивалентная масса
Находим эквивалентные массы солей по формуле:



Определим общую жесткость:

Задача 8..
Какую массу гашеной извести надо прибавить в 2,5 л воды, чтобы
устранить временную жесткость, равную 4,43 ммоль/л ?
Решение. Из формулы (9) выразим массу гашеной извести, необходимую для
устранения временной жёсткости воды.

Эквивалентная масса извести исходя из формулы (11) равна:

отсюда

Задача 9.
Для умягчения 100 л волы потребовалось 12,72 г Na2CO3. Чему
равна жёсткость воды (в град, и ммоль/л).
Решение. Определяем жёсткость по формуле, а эквивалентную массу
Na2C03 по формуле:

Один градус жёсткости соответствует содержанию 1 г СаО в 100 л
воды.
Для перехода на карбонат натрия необходимо составить
пропорцию:
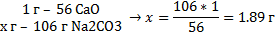
То есть 1 градус жёсткости соответствует 1,89 г Na2C03.
Жёсткость будет равна:

Задача 10.
Вода объёмом 1 л содержит 48,6 мг Са(НСО3)2 и 29,6 мг MgSО4.
Какое количество Са2+ и Mg2+ содержится в 1 л воды. Чему равна общая
жёсткость воды?
Решение. Для определения общей жёсткости воспользуемся формулой(13),
а для нахождения эквивалентных масс солей, формулой (10):

Найдём общую жесткость воды:

Определим количество ионов Са и Mg из расчёта Сa(HCO3)2 и MgSO4
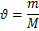


12. Тестовые задания.
|
из
5.00
|
Обсуждение в статье: Водородный показатель равен 1,3. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

