 |
Главная |
Кинетическая классификация простых гомогенных химических реакций
|
из
5.00
|
С точки зрения химической кинетики простые химические реакции классифицируют на реакции нулевого, первого, второго и третьего порядков. Реакции нулевого порядка встречаются чрезвычайно редко. Для того чтобы реакция протекала по нулевому порядку необходимы специфические условия её проведения. Например, реакция разложения оксида азота (5+) N2O5 → N2O4 + ½ O2 протекает как реакция нулевого порядка только в случае твёрдого оксида азота (5+).
Если же взят газообразный оксид, то реакция протекает как реакция первого порядка.
В то же время следует сказать, что встречается большое количество реакций, в которых частный порядок по какому-либо веществу равен нулю. Обычно это реакции, в которых данное вещество взято в большом избытке по сравнению с остальными реагентами. Например, в реакции гидролиза сахарозы
С12Н22О11 + Н2О → С6Н12О6 + С6Н12О
Сахароза Глюкоза Фруктоза
частный порядок реакции по воде равен нулю.
Самыми распространёнными являются реакции первого и второго порядков. Реакций третьего порядка мало.
Рассмотрим для примера математическое описание кинетики химической реакции первого порядка. Решим кинетическое уравнение такой реакции
 = kC.
= kC.
Разделим переменные dC = – kdt. После интегрирования
∫ 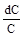 = -∫kdt.
= -∫kdt.
получим
ln С = – kt + const.
Найдём постоянную интегрирования, учитывая начальное условие: в момент времени t = 0 концентрация равна начальной С = С0. Отсюда const = ln C0 и
ln С = ln С0 – kt,
ln С – ln С0 = – kt,
ln  = – kt,
= – kt,
C = C0∙ e-kt.
Это интегральное кинетическое уравнение реакции первого порядка.
Важной кинетической характеристикой реакции любого порядка является время полупревращения τ½. Временем полупревращения называют время, в течение которого реагирует половина начального количества вещества. Найдём выражение для времени полупревращения реакции первого порядка. Для t = τ½ C = C0/2. Поэтому
ln 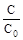 = ln
= ln 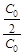 = – kt,
= – kt,
k τ½ = ln 2.
Отсюда
τ½ = 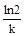 =
= 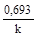 .
.
Результаты решения дифференциальных кинетических уравнений для реакций всех порядков представим в виде таблицы (табл. 2). Данные этой таблицы относятся к случаю, когда все вступающие в реакцию вещества имеют одинаковые начальные концентрации.
Таблица – Кинетические характеристики простых гомогенных реакций
| Кинетическая характеристика | Порядок химической реакции | |||
| n = 0 | n = 1 | n = 2 | n = 3 | |
| 1 Дифференциальное кинетическое уравнение | 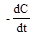 = k. = k.
| 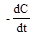 = kC. = kC.
| 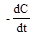 = kC2. = kC2.
|  = kC3. = kC3.
|
| 2 Интегральное кинетическое уравнение | С0 - С = kt | C = C0∙e-kt | (  ) = kt ) = kt
| (  ) = 2kt ) = 2kt
|
| 3 Константа скорости реакции, её размерность | k = 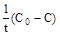 [(моль/л)∙с-1]
[(моль/л)∙с-1]
| k =  [с-1]
[с-1]
| k =  [(моль/л)-1∙с-1]
[(моль/л)-1∙с-1]
| k =  [(моль/л)-2∙с-1]
[(моль/л)-2∙с-1]
|
| 4 Время полупревращения | τ½ = 
| τ½ = 
| τ½ = 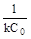
| τ½ = 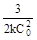
|
| 5 Функция, линейно зависящая от времени | C | ln C | 
| 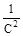
|
|
из
5.00
|
Обсуждение в статье: Кинетическая классификация простых гомогенных химических реакций |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

