 |
Главная |
Термодинамический анализ основной реакции
|
из
5.00
|
Исходные данные для термодинамических расчётов
Процесс окисления ацетальдегида в ацетилен протекает согласно следующему уравнению химической реакции:
СН2 = СН2 + 0,5О2  СН3СНО
СН3СНО
Справочные данные термодинамических величин исходных веществ и продукта реакции имеют следующие значения[19]:
| Вещество | ΔН°f, 298, кДж/моль | S°298, Дж/моль•К | с°р= f(T) | |||
| a | b•103 | c'•10-5 | c•106 | |||
| СН3СНО | -166 | 264,20 | 13,00 | 153,50 | — | -53,70 |
| С2Н4 | 52,30 | 219,45 | 11,32 | 122,01 | — | -37,90 |
| О2 | 0 | 205,04 | 31,46 | 3,39 | -3,77 | — |
Расчёт термодинамических функций
Установим зависимость изменения теплоёмкости от температуры Δср= f(T):
Δср=Δa + ΔbT + Δc'T-2 + ΔcT2
Δa=Σ(υa)j – Σ(υa)i = –14,05
Δb= Σ(υb)j – Σ(υb)i = 29,79•10-3
Δc'= Σ(υc')j – Σ(υc')i = 1,88•105
Δc= Σ(υc)j – Σ(υc)i = –15,8•10-6
Стандартные значения изменений термодинамических величин:
ΔН°298 = Σ(υ ΔН°f, 298)j – Σ(υ ΔН°f, 298)i = –218,3 кДж/моль
ΔН°298<0, следовательно реакция экзотермична
ΔS°298 = Σ(υ S°298)j – Σ(S°298)i = –57,77 Дж/моль•К
Согласно уравнению Гиббса-Гельмгольца
ΔG°298 = ΔН°298 – T• ΔS°298 = –201,08 кДж/моль
ΔG°298 <0, следовательно при стандартных условиях реакция может протекать в прямом направлении.
Определим зависимость ΔН°T= f(T), подставив Δср= f(T) в уравнение Кирхгофа:
ΔН°T= ΔН°298 + Δc°pdt = ΔН°298 + Δa(T – 298) + Δb(T2 – 2982)/2 – Δc'(T-1 – 298-1)+ Δc(T3 – 2983)
Подставив в полученную зависимость значения температур в интервале 25 – 175°С, найдём характер изменения зависимости ΔН°f= f(T):
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т , кДж/моль | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
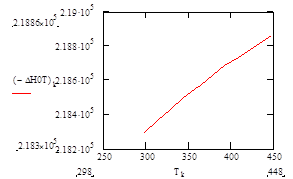
Рис.5 Зависимость теплового эффекта реакции –ΔН°от температуры.
Определим зависимость ΔS°= f(T)
ΔS°T= ΔS°298 + Δc°pdt/T = ΔS°298 + Δa(lnT – ln298) + Δb(T – 298) –
–Δc'/2(T-2 – 298-2)+ + Δc/2(T2 – 2982)
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔS° Т , Дж/моль | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
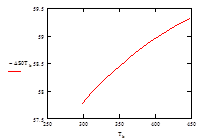
Рис.6 Зависимость изменения энтропии ΔS° от температуры
Пользуясь уравнением Гиббса-Гельмгольца:
ΔG°T = ΔН°T – T • ΔS°T,
рассчитаем значения ΔG° при соответствующих температурах:
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔG° Т , кДж/моль | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
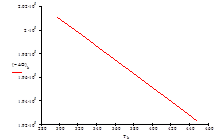
Рис.7 Зависимость изменения энергии Гиббса ΔG от температуры
Пользуясь уравнением изотермы Вант-Гоффа:
ΔG = – RT•lnkp,
вычислим значения констант равновесия:
lnkp = – ΔG /(RT)
| Т, К | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| lnkp | 76,9388 | 73,1007 | 69,5973 | 66,3866 | 65,7352 | 62,5208 | 59,8453 | 57,3843 | 53,6606 | 51,6252 |
| kp | 2,59•1033 | 5,59•1031 | 1,68•1030 | 6,78•1028 | 2,47•1028 | 1,39•1027 | 9,78•1025 | 8,35•1024 | 2,02•1023 | 2,63•1022 |
Сведём полученные данные в таблицу термодинамических функций реакции:
| Т, КТ, К | 298 | 313 | 328 | 343 | 358 | 363 | 378 | 393 | 408 | 433 | 448 |
| –ΔН° Т кДж/моль | 218,3 | 218,37 | 218,43 | 218,49 | 218,55 | 218,57 | 218,63 | 218,68 | 218,74 | 218,82 | 218,86 |
| –ΔS° Т Дж/моль | 57,77 | 57,98 | 58,19 | 58,37 | 58,54 | 58,60 | 58,75 | 58,89 | 59,03 | 59,22 | 59,32 |
| –ΔG° Т кДж/моль | 201,08 | 200,22 | 199,35 | 198,47 | 197,59 | 197,30 | 196,42 | 195,54 | 194,65 | 193,18 | 192,29 |
| kp | 1,77•1035 | 2,59•1033 | 5,59•1031 | 1,68•1030 | 6,78•1028 | 2,47•1028 | 1,39•1027 | 9,78•1025 | 8,35•1024 | 2,02•1023 | 2,63•1022 |
Выводы
1. Выполненные расчёты термодинамических функций показывают, что реакция окисления этилена в ацетальдегид идёт с выделением теплоты. Причём с увеличением температуры реакционной массы абсолютное значение ΔН°Т немного увеличивается. Согласно принципу Ле-Шателье для увеличения выхода продукта реакции, идущей с выделением теплоты, необходимо осуществлять отвод тепла от реакционной смеси.
2. Изменение энтропии для данной реакции во взятом интервале температур отрицательно. То есть в изолированной системе самопроизвольное протекание данной реакции в прямом направлении невозможно. Значение ΔS° Т с повышением температуры возрастает, следовательно возрастают и термодинамические трудности протекания процесса. Однако на практике имеют дело с неизолированными системами и этот параметр в нашем случае не может служить критерием направленности химической реакции.
3. О направленности химической реакции в изобарно-изотермических условиях судят по значению изменения свободной энергии Гиббса ΔG° Т. Расчёт показывает, что ΔG° Т во всём изученном интервале температур отрицательно, следовательно в пределах этих температур возможно самопроизвольное протекание реакции в прямом направлении. При увеличении температуры абсолютное значение изменения свободной энергии Гиббса уменьшается, значит с увеличением температуры возникают трудности для протекания процесса в прямом направлении. Следовательно при проведении процесса необходимо отводить тепло, выделяющееся в ходе реакции.
4. Константы равновесия для всего интервала температур значительно больше единицы, поэтому в реакционной смеси при достижении состояния равновесия продукты реакции будут существенно преобладать над исходными веществами. С увеличением температуры соотношение между продуктами реакции и исходными веществами в равновесном состоянии будет уменьшаться (уменьшается значение kp), следовательно и выход продукта уменьшится. Для увеличения выхода необходимо постоянно охлаждать реакционную смесь, отводя выделяющуюся теплоту.
Таким образом для получении максимально возможного выхода ацетальдегида при проведении окисления этилена кислородом следует выбрать реактор, оснащённый теплообменной рубашкой.
|
из
5.00
|
Обсуждение в статье: Термодинамический анализ основной реакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

