 |
Главная |
Кинетика процесса автоклавного выщелачивания
|
из
5.00
|
Кинетика гетерогенной реакции рассматриваемого типа складывается из ряда последовательных стадий: переноса реагента из объема раствора к поверхности твердой фазы через пограничный слой жидкости; диффузии реагента через слой твердого продукта реакции (слой СаСОз на частицах шеелита); химической реакции на поверхности шеелита; переноса продукта реакции (Na2WO4) в объем раствора. Исследования кинетики взаимодействия шеелита (в форме пластинок с известной поверхностью) с растворами соды в интервале 150—200 °С показали, что пленки СаСОз пористые и вплоть до толщины 110 мкм не влияют на скорость процесса. Пористость пленки объясняется тем, что молярный объем СаСОз меньше молярного объема CaW04 (отношение молярных объемов равно 0,75). При интенсивном перемешивании взаимодействие протекает в кинетической области, энергия активации процесса E=75-92,кДж /моль. Следует учитывать, что при недостаточной интенсивности перемешивания (что имеет место в горизонтальныхвращающихся автоклавах) реализуется промежуточный режим: скорость процесса определяется и скоростью подвода реагента к поверхности, и скоростью химического взаимодействия.
Таблица 1. Зависимость Кс и степени извлечения вольфрама Е от температуры и содового эквивалента Q
| tºc | Q | E, доли единиц | Кс | tºc | Q | E, доли единиц | Kc | |
| 90 | 1 | 0,316 | 0,46 | 225 | 0,75 | 0,495 | 1,56 | |
| 175 | 1 | 0.547 | 1.21 | 225 | 1 | 0.608 | 1.56 | |
| 200 | 1 | 0.586 | 1.45 | 225 | 1.5 | 0.899 | 1.49 | |
| 200 | 1 | 0.829 | 1.19 | 225 | 2.0 | 0.995 | 0.99 | |
| 200 | 1 | 0.979 | 0.96 | 225 | 1.0 | 0.634 | 1.85 | |
| 200 | 1 | 0.994 | 0.67 | 225 | 1.5 | 0.923 | 1.61 |
Принимая, что реакция первого порядка по реагенту, и учитывая ее обратимость, удельную скорость процесса в кинетической области можно представить как:
I = K ([Na2CO3] - [Na2WO4]/ Kc), (1.1)
где К—константа скорости реакции; К.с—константа равновесия; [Na2CO3 и [Na2WO4] - концентрации соды и вольфрамата натрия в объеме раствора. [1]
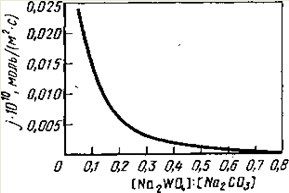
Рис. 1 Зависимость удельной скорости реакции разложения шеелита от молярного отношения концентрации Na2WO4/Na2CO3 в растворе при 175 °С.
Как видно из рис.1, удельная скорость реакции уменьшается примерно обратно пропорционально возрастанию отношения молярных концентраций [Na2WO4]: [Na2СО3] в растворе, что соответствует уравнению c переменной I.
Это обусловливает необходимость применения значительного "кинетического" избытка соды. С целью снижения расхода соды проводят двустадийное противоточное выщелачивание: хвосты после первого выщелачивания, содержащие 15-20 % WOз от исходного количества, выщелачивают, используя большой избыток соды. Получаемый раствор, являющийся оборотным, поступает на первую стадию процесса. Однако расход соды и в этом случае не ниже 250 % от СНК.
Шеелитовые концентраты легче разлагаются растворами соды по сравнению с вольфрамитовыми. Добавление в автоклавную пульпу NaOH или СаО (что приводит к каустификации соды) позволяет снизить расход соды.
Содержание примесей в щелоках автоклавно-содового процесса определяется взаимодействием сопутствующих минералов с растворами соды при 200—225 °С. В растворах могут присутствовать примеси соединений Si, P, As, F, Mo, A1. Для окисления примеси молибденита (с целью извлечения молибдена в вольфраматный раствор), а также удаления примеси мышьяка применяют предварительный обжиг вольфрамовых концентратов при 650—700°С. Удаление флотореагентов в процессе обжига улучшает показатели автоклавно-содового разложения вследствие исключения вспенивания пульп. В таблице 2 приведены сопутствующие компоненты шеелитового концентрата, их форма нахождения в концентрате и характер взаимодействия с растворами соды при выщелачивании.
Таблица 2. Характер взаимодействия сопутствующих минералов шеелитовых концентратов с растворами соды при 200—225 °С
| Элемент | Минерал | Характер взаимодействия минерала с растворами соды | Соединение, пере-ходящее в раствор |
| Фосфор | Апатит Са5(Р04)зF | Частично реагирует по обменной реакции с образованием фосфата и фторида натрия | Na2HPО4; (NaF) |
| Мышьяк | Арсенопирит FeAsS Скородит FeAs04 | Частично реагирует с образованием рас творимой тиосоли Реагирует с образованием арсената нагрия | Na2HAs04 Na2HAs04 |
| Фтор | Флюорит CaF2 | Частично реагирует По обменной реакции | NaF |
| Кремний и алюминий | Кварц, силикаты, алюмосиликаты | Реагирует с образованием растворимых Силикатов и алюминатов натрия | Na2SiO3, NaAl(OH)4 |
| Молибден | Молибденит MoS2 Повеллит СаМо04 | Не реагирует при отсутствии окислителя Реагирует по обменной реакции | — Na2Mo04 |
| Олово | Касситерит SnO2 | Практически не реагирует | — |
| Медь | Халькопирит CuFeS2 | Частично реагирует с образованием неустойчивых комплексных анионов Сu(СОз)2 | Комплекс разлагается с выделением Сu(ОН)2 |
| Сурьма | Антимонит Sb2S3, | Практически не реагирует | — |
| Висмут | Висмутииит Bi2S3 | То же | — |
| Кальций | Кальцит СаСОз | — |
|
из
5.00
|
Обсуждение в статье: Кинетика процесса автоклавного выщелачивания |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

