 |
Главная |
Получение вольфрамовой кислоты из растворов вольфрамата натрия
|
из
5.00
|
Вольфрамовую кислоту можно непосредственно выделить из раствора вольфрамата натрия соляной или азотной кислотами.
Na2WО4 +2HCl = H2WO4 + NaCl (9)
Однако этот способ применяют редко вследствие трудностей отмывки осадков от ионов натрия, содержание которых в триоксиде вольфрама лимитировано.
Большей частью первоначально из раствора осаждают вольфрамат кальция, который затем разлагают кислотами. Вольфрамат кальция осаждают, добавляя в нагретый до 80-90 С раствор вольфрамата натрия раствор СаС12; при остаточной щелочности раствора 0,3-0,7 %. При этом выпадает белый мелкокристаллический легко отстаивающийся осадок, в маточном растворе остаются ионы натрия, что обеспечивает низкое их содержание в вольфрамовой кислоте. Из раствора осаждается 99-99,5 % W, маточные растворы содержат 0,05-0,07 г/л W03. Отмытый водой осадок CaWO4 в виде пасты или пульпы поступает на разложение соляной кислотой при нагревании до 90 °С:
CaWO4 + 2HCI = H2WO4 + CaCl2. (10)
При разложении поддерживают высокую конечную кислотность пульпы (90-100 г/л НС1), что обеспечивает отделение вольфрамовой кислоты от примесей соединений фосфора, мышьяка и отчасти молибдена (молибденовая кислота растворяется в соляной кислоте). Осадки вольфрамовой кислоты требуют тщательной отмывки от примесей (особенно от солей кальция)[3].
Очистка технической вольфрамовой кислоты
Техническая вольфрамовая кислота полученная выше описанным способом содержит 0,2 –0.3% примесей. Основная примесь кремний. В результате прокаливания кислоты при Т = 500 – 600 получают триоксид вольфрама, пригодный для производства твердых сплавов на основе карбида вольфрама. Для производства вольфрама необходим триоксид более высокой чистоты.
Часто используют амиачный способ очистки вольфрамовой кислоты. Она легко растворяется в амиачной воде, при этом большая часть примесей оседает в осадок, но раствор может содержать примесь молибдена, соли щелочных металлов. Из амиачного раствора выделяют ПВА в результате выпаривания и охлаждения. Оставшийся вольфрам из раствора осаждают в виде CaWO4 и H2WO4. Эти соединения возвращают вверх схемы, CaWO4 отправляют на операцию разложения осадка CaWO4, а H2WO4 отправляют на стадию растворения в аммиаке технической вольфрамовой кислоты[2].
4.5 Получение WO3
Триоксид вольфрама получают термическим прокаливанием ПВА и вольфрамовой кислоты:
(NH4)10H2W12O42*4H2O=12WO3+10NH3+10H2O (11)
H2WO4 = WO3 + H2O (12)
H2WO4 (при 500°С полностью теряет воду), 5(NH4)2OŸ12WO3ŸnH2O (>250°С разлагается нацело)
Температура прокаливания ПВА Т = 500 - 850ºС. Вольфрамовую кислоту прокаливают при 750¸850°С в барабанной вращающейся электропечи. Она представляет собой трубу из нержавеющей жаропрочной стали (длиной ~2,5м), которую помещают в нагревательную камеру (печь). Печь наклонена на 2¸3° к горизонту. Наклон печи и вращение обуславливают перемешивание и перемещение материала по винтовой линии. Заполнение печи материалом составляет 8¸15%. Загрузка производится шнековым питателем. Труба вращается от электродвигателя. К выгрузочному отверстию прикреплено барабанное сито с отверстиями 1,2¸3 мм. Для получения вольфрама важна величина частиц WO3. Она зависит от условий получения кислоты и от температуры прокаливания. Величина частиц или зернистость любого порошка косвенно характеризуется величиной насыпного веса (вес в граммах, единицы объёма свободно насыпанного порошка)[4].
Расчет специальной части курсовой работы
Задание
На предприятии получают в сутки 100 м3 автоклавных щелоков. Рассчитать суточный расход соляной кислоты (30% - ой) для неитролизации растворов и кол-во выделяющегося сероводорода при осаждении молибдена из раствора в виде трисульфида (MoS3).
Состав автоклавных щелоков: г/л;
Na2WO3 - 100; Mo – 5 (в виде Na2MoO4);
Na2CO3 - 80 ; SiO2 - 2 (в виде Na2SiO3)
Решение
Рассчитаем кол-во веществ находящихся в 100 м3 автоклавных щелоков, т.к 100 м3=100000 л то:
Na2WO4 будет: 100 г/л * 100000 л = 10000 кг;
Na2CO3 будет: 80 г/л * 100000 л = 8000 кг;
Na2SiO3 : т.к. SiO2 - 2 г/л
в перещёте на Na2SiO3 будет:
Na2SiO3= m(SiO2)*M(Na2SiO3)/M(SiO2) = 2*122/60=4,066 г/л,
Na2SiO3 в 100 м3 будет: 4,066 г/л * 100000 л = 406,66 кг;
Na2MoO4: т.к. Mo – 5 г/л
в перещёте на Na2MoO4 будет:
Na2MoO4= m(Mo)*M(Na2MoO4)/M(Mo) = 5*206/96=10,73 г/л,
Na2MoO4 в 100 м3 будет: 10,73 г/л * 100000 л = 1073кг.
Рассчитаем кол-во образовавшегося Na2MoS4 по реакции:
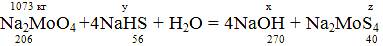
x = (1073*270)/206 =1406,36 кг;
y = (1073*4*56)/206 =1166,757 кг;
z = (1073*4*40)/206 = 833,4 кг.
Рассчитаем кол-во HCI для неитролизации раствора и осаждения MoS3 и кол-во выделяющегося H2S:
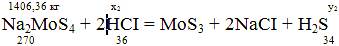
x2 = (1406,36*2*36)/270 = 375,03 кг;
y2 = (1406,36*34)/270 = 177,097 кг;
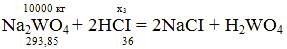
x3 =(10000*2*36)/293,85 = 2450,23 кг;
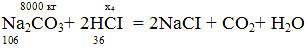
x4 = (8000*2*36)/106 = 5433,96 кг;
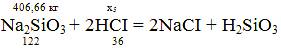
x5 = (406,66*2*36)/122 = 239,99 кг;
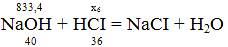
x6= (833,4*36)/40 = 750,06 кг.
Найдем общий расход соляной кислоты на неитролизацию:
m(HCI) = x2+x3+x4+x5+x6 = 239,99+5433,96+2450,23+375,03+750,06 = 9249,27 кг;
m(HCI – 30%-ой) = 9249,27/0,3 = 30830,9 кг.
Ответ: На нейтрализацию 100 м3 автоклавных щелоков потребуется 30830,9 кг соляной кислоты (30% - ой) и при этом выделится 177,097 кг сероводорода.
Заключение
Автоклавное выщелачивание является наиболее интенсивным вариантом вскрытия разнообразного вида минерального сырья и полупродуктов. Особенно для вскрытия шеелитовых концентратов этот способ особенно эффективен и наиболее применим в производстве. Это достигается за счет использования повышенных температур (400-600 К), давлений реакционного газа (0,2-0,15МПа). Поскольку процесс осуществляется в герметичной аппаратуре, это и наиболее экологически оптимальный вариант выщелачивания, обеспечивающий эффективное использование теплоносителя и реакционного газа. Но используемая для этого процесса аппаратура дорогая и сложная в эксплуатации. Так же к недостаткам процесса следует отнести большой расход Na2СО3, высокая концентрация избыточной Na2СО3 влечет за собой повышенный расход кислот на нейтрализацию растворов и соответственно большие затраты на утилизацию растворов. Возможен большой расход пара, это решается с помощью теплоизоляции, теплообменника.
Список литературы
1) Зеликман А.Н., Никитина Л.С. Вольфрам: Учебник для студентов вузов.- М.: Металлургиздат, 1978. – 272с.
2) Зеликман А.Н., Коршунов Б.Г. Металлургия редких металлов: Учебник для вузов. - 2-е издание.- М.: Металлургия, 1991.- 432с.
3) Зеликман А.Н. Металлургия тугоплавких металлов.: Учебник для студентов вузов. – М.: Металлургизд, 1986.- 395с.
4) Конецкий Ч.В. Структура и свойства тугоплавких металлов: Учебник для студентов вузов. – М.: Металлургия, 1974.- 206с.
|
из
5.00
|
Обсуждение в статье: Получение вольфрамовой кислоты из растворов вольфрамата натрия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

