 |
Главная |
Классификация анионов, основанная на их окислительно-восстановительных свойствах
|
из
5.00
|
Качественный анализ анионов. Аналитическая классификация анионов по группам (по способности к образованию малорастворимых соединений, по окислительно-восстановительным свойствам). Ограниченность любой классификации анионов по группам
Анализ анионов существенно отличается от анализа катионов. Если для катионов существует систематический ход анализа, построенный на последовательном делении их на группы с помощью групповых реакций, то для анионов такого строго систематического анализа нет.
Разнообразные классификации анионов основаны на реакциях осаждения, разложения, комплексообразования, окисления-восстановления. В качестве групповых реагентов используют соли бария, серебра, кальция, свинца, цинка, смеси солей бария и кальция. Эти реактивы применяют при различных значениях pH раствора. В качестве групповых реагентов на анионы легко разлагаемых кислот используют также растворы кислот (CH3COOH, HCl). Различные отношения анионов к окислителям (KMnO4 + H2SO4) или восстановителям (KI + H2SO4) также позволяет делить анионы на группы по различию их окислительно-восстановительных свойств. Есть классификации, основанные на использовании различных реактивов, в которых число групп анионов колеблется от 3 до 7.
Так, например, при делении анионов на три группы они распределяются следующим образом:
Анионы, образующие осадки с растворимыми солями бария;
Анионы, образующие осадки с растворимыми солями серебра;
Анионы, не образующие осадков ни с растворимыми солями бария, ни с растворимыми солями серебра;
Классификация анионов, основанная на реакциях осаждения
| Группа | Анионы | Групповой признак | Групповой реагент | |
| I | NO2-, Cr2O72-, AsO43-, BrO3- | Окислители: выделение свободного иона | KI + H2SO4 | |
| NO3-, NO2-, Cr2O72-, MnO4- | Окислители: выделение MnCl62-, бурого цвета | MnCl2 + HClконц | ||
| II | S2-, SO32-,S2O32-, NO2-,С2O64-,Cl-,Br-,I-, CN-, SCN-, AsO33- | Восстановители: обесцвечивание раствора KMnO4 с образованием Mn2+. | KMnO4 + H2SO4 | |
| S2-, SO32-,S2O32-, AsO33- | Восстановители: восстановление I2до I-. Исчезновение синий окраски йодокрахмального комплекса. | I2 в KI, подкисленный H2SO4(+ крахмал) | ||
| III | SO42-,CO32-, PO43-,CH3COO-,SiO32-,B4O72- | Индифферентные | Отсутствует |
При делении анионов на семь групп различают:
Анионы, бариевые соли которых растворимы в воде, серебряные соли малорастворимы в воде, но растворимы в азотной кислоте(NO2-, CH3COO-, HCOO-,CNO-, S2-). Анионы второй группы с BaCl2 или Ba(NO3)2 осадка не образуют. AgNO3 осаждает из достаточно концентрированных растворов соответствующие серебряные соли.
Анионы, бариевые соли которых малорастворимы в воде, но растворимы в НNO3, серебряные соли окрашены в различные цвета, не растворимы в воде и растворимы в НNO3(C2O42-, S2O32-, AsO33-,AsO43-, PO43-).
Анионы, бариевые и серебряные соли которых ведут себя подобным образом, как и соответствующие соли III группы, но их серебряные соли белого цвета(BrO2-, C2O42-,C2H4O62-, CO32-, SO32-,IO3-).
Анионы, бариевые и серебряные соли которых растворимы в воде(ClO3-,ClO4-,S2O82-, NO3-).
Анионы, бариевые соли которых не растворимы в воде и НNO3, а серебряные соли растворимы в воде (SiF62-, F-, SO42-). С анионами этой группы катионы бария образуют белые нерастворимые осадки, а AgNO3 не вызывает образование осадка.
Анионы кремниевой, титановой, циркониевой, вольфрамовой и некоторых других кислот, соли щелочных металлов, которые растворимы в воде, а бариевые и серебряные соли не растворимы.
По окислительно-восстановительным свойствам анионы также обычно делят на три группы. По этой классификации групповыми реагентами являются окислители или восстановители, у которых окислительная или восстановительная форма окрашена.
Классификация анионов, основанная на их окислительно-восстановительных свойствах
| Группа | Анионы | Групповой признак | Групповой реагент | |
| I | NO2-, Cr2O72-, AsO43-, BrO3- | Окислители: выделение свободного иона | KI + H2SO4 | |
| NO3-, NO2-, Cr2O72-, MnO4- | Окислители: выделение MnCl62-, бурого цвета | MnCl2 + HClконц | ||
| II | S2-, SO32-,S2O32-, NO2-,С2O64-,Cl-,Br-,I-, CN-, SCN-, AsO33- | Восстановители: обесцвечивание раствора KMnO4 с образованием Mn2+. | KMnO4 + H2SO4 | |
| S2-, SO32-,S2O32-, AsO33- | Восстановители: восстановление I2до I-. Исчезновение синий окраски йодокрахмального комплекса. | I2 в KI, подкисленный H2SO4(+ крахмал) | ||
| III | SO42-,CO32-, PO43-,CH3COO-,SiO32-,B4O72- | Индифферентные | Отсутствует |
57.Аналитические реакции анионов I группы по кислотно – основной классификации ( SO 4 2- , SO 3 2- , S 2 O 3 2- , С2 O 4 2- , CO 3 2- , В4О72- (В O 2 - ), PO 4 3- , А sO 4 3- , А sO 3 3- , F - ).
Групповой реагент – водный раствор BaCl2.
Реакции с групповым реагентом проводят в нейтральной или слабо щелочной среде, так как осадки соответствующих бариевых солей малорастворимы в данных условиях.
Аналитические реакции сульфат – иона SO42-.
Сульфаты аммония и многих металлов хорошо растворяются в Н2О. Сульфаты кальция, стронция, бария, свинца (II) малорастворимы в воде, что широко используется в химическом анализе.
1. Реакция с катионами бария (фармакопейная).
ВаCl2 +Na2 SO4 →BaSO4↓ (белый мелкокристаллический) + 2NaCl
Ва2+ +SO42- →BaSO4↓ (белый мелкокристаллический)
· BaSO4 не растворяется в минеральных кислотах, за исключением концентрированной Н2SO4, в которой он частично растворим с образованием Ba(HSO4)2:
ВаSO4 + Н2SO4 →Ba(НSO4)2
2. Реакция с катионами свинца.
PbCl2+Na2 SO4→PbSO4↓ (белый кристаллический) + 2NaCl
Pb2++SO42-→PbSO4↓ (белый кристаллический)
· Осадок PbSO4 частично растворяется в минеральных кислотах; растворяется в щелочах и в водных растворах ацетатов натрия СН3СООNa или аммония СН3СООNН4 с образованием комплексных соединений:
PbSO4 + 4 NaOH → Na2[Pb(OH)4] + Na2SO4
3. Реакция с родизонатом бария.
Сульфат-ионы при взаимодействии с красным родизонатом бария разрушают его с образованием сульфата бария, вследствие чего красный родизонат бария обесцвечивается:
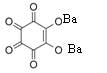 + SO42- = BaS04 +
+ SO42- = BaS04 + 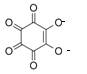
родизонат бария родизонат-анион — остаток родизоновой кислоты H2C6H6
Реакция высокочувствительна: предел обнаружения 5 мкг. Реакцию обычно проводят капельным методом на фильтровальной бумаге.
Аналитические реакции сульфит – иона SO32-.
1. Реакция с хлоридом бария (фармакопейная).
Ва Cl2 +Na2 SO3→BaSO3↓(белый кристаллический) + 2NaCl
Ва 2+ +SO32-→BaSO3↓(белый кристаллический)
· Осадок растворяется в разбавленных НСl и HNO3 с выделением газообразного диоксида серы SO2:
BaSO3+ 2 НСl→SO2↑ + ВаCl2+ Н2О
2. Реакция с нитратом серебра.
2 AgNO3 +Na2 SO3-→Ag2SO3↓( белый ) + 2 NaNO3
2 Ag + + SO 3 2- → Ag 2 SO 3 ↓(белый)
Растворение осадка
· Осадок растворяется при избытке сульфит – ионов с образованием растворимых комплексных дисульфитоаргентат (I) – ионов [Ag(S2O3)2]3-:
Ag2SO3+ 3SO32-→ 2 [Ag(SO3)2]3-
В другой пробирке аналогично получают белый осадок сульфита серебра и кипятят смесь осадка с раствором. Осадок постепенно темнеет, за счет выделения оксида серебра Ag2O:
Ag2SO3→Ag2O+SO2
3. Реакция разложения сульфитов кислотами (фармакопейная).
Na 2 SO3+ 2 Н Cl →SO2↑ + Н2О + 2 NaCl
SO32-+ 2 Н+ →SO2↑ + Н2О
Выделяющийся диоксид серы SO2 обнаруживают по характерному запаху, а также по обесцвечиванию водного раствора йода или перманганата калия:
SO2 + I2 + 2 H2O → H2SO4 + 2 HI
5 SO2 + 2 KMnO4 + 2 Н 2 О → K2SO4 + 2 MnSO4 + 2 H2SO4
4. Реакция с перманганатом калия.
5 Na 2 SO 3 + 2 KMnO 4 + 6 Н2 SO 4 → 2 Mn SO 3 + 5 Na 2 SO 4 + 3 H 2 O + K 2 SO 4
5 SO32-+ 2MnO4-+ 6 Н + → 2Mn2++ 5SO42-+ 3H2O
В кислой среде сульфит – ионы окисляются до сульфат – ионов, при этом розовый раствор перманганата калия обесцвечивается.
В нейтральной среде сульфит – ион при реакции с MnO4- - ионом также окисляется до сульфат – иона, при этом кроме обесцвечивания образуется темный хлопьевидный осадок MnO(OH)2:
3 SO32- + 2 MnO4- + 3 H2O → 2 MnO(OH)2 + 3 SO42- + 2 ОН -
5. Реакция с раствором йода (фармакопейная).
SO32-+I2 (желто-бурый) +H2O→SO42-+ 2I- (бесцветный) + 2 Н+
Реакцию проводят в нейтральных или слабо кислых растворах.
6. Реакция восстановления сульфит – иона металлическим цинком в кислой среде.
SO32- + 2 Н + → SO2 + Н 2 О
SO2 + 3 Zn + 6 Н + → H2S + 3 Zn2+ + 2 H2O
Признаки реакции: полоска фильтровальной бумаги, смоченная раствором соли свинца чернеет:
H2S+Pb2+ →PbS+ 2H+
Аналитические реакции карбонат – иона СO32-.
1. Реакция с хлоридом бария.
Ва Cl 2 + Na 2 СО3→ ВаСО3↓(белый мелкокристаллический)+ 2 NaCl
Ва2++ СО32-→ ВаСО3↓(белый мелкокристаллический)
Осадок растворяется в минеральных кислотах и в уксусной кислоте. В растворе H2SO4 образуется белый осадок BaSO4.
· К осадку медленно, по каплям прибавляют раствор HCl до полного растворения осадка:
ВаСО3+ 2HCl→ ВаСl2 + СО2↑ +H2O
2. Реакция с сульфатом магния (фармакопейная).
MgSO4+Na2 CO3→MgCO3↓( белый ) + Na2 SO4
Mg 2+ + CO 3 2- → MgCO 3 ↓(белый)
Гидрокарбонат – ион НСО3- образует с сульфатом магния осадок MgCO3 только при кипячении:
MgSO 4 + 2 Na Н CO 3 → MgCO 3 + СО2↑ + Н2О + Na 2 SO 4
Mg2++ 2 НCO3-→MgCO3+ СО2↑ + Н2О
· Осадок MgCO3 растворяется в кислотах.
3. Реакция с минеральными кислотами (фармакопейная).
CO32-+ 2 Н3О+ = Н2СО3+ 2 Н2О
НCO3-+ Н3О+ = Н2СО3+ Н2О
Н2СО3→ СО2↑ + Н2О
Признаки реакции: Выделяющийся газообразный СО2 обнаруживают по помутнению баритоновой или известковой воды в приборе для обнаружения газов.
4. Реакция с гексацианоферратом (II) уранила.
2СО32-+ (UO2)2[Fe(CN)6](коричневый)→ 2UO2CO3 (бесцветный) + [Fe(CN)6]4-
Коричневый раствор гексацианоферрата (II) уранила получают, смешивая раствор ацетата уранила (СН3СОО)2UO2 c раствором гексацианоферрата (II) калия:
2 (СН3СОО)2ГО2+ К4[Fe(CN)6]→ (UO2)2[Fe(CN)6] + 4CH3COOK
К полученному раствору прибавляют по каплям раствор Na2CO3 или К2СО3 при перемешивании до исчезновения коричневой окраски.
5. Раздельное открытие карбонат – ионов и гидрокарбонат – ионов реакциями с катионами кальция и с аммиаком.
Если в растворе одновременно присутствуют карбонат – ионы и гидрокарбонат – ионы, то каждый из них можно открыть раздельно.
Для этого вначале к анализируемому раствору прибавляют избыток раствора СаСl2. При этом СО32- осаждаются в виде СаСО3:
Na2 СО3+ СаСl2→ СаСО3+ 2 NaCl
СО32-+ Са2+ → СаСО3
Гидрокарбонат – ионы остаются в растворе, так как Са(НСО3)2 растворами в воде.
Осадок отделяют от раствора и к последнему добавляют раствор аммиака. НСО2- - анионы с аммиаком и катионами кальция дают снова осадок СаСО3:
НСО3-+ Са2++NH3→CaCO3+NH4+
Карбонат – ионы при реакции с хлоридом железа (III)FeCl3образуют бурый осадок Fe(OH)CO3, с нитратом серебра – белый осадок карбоната серебраAg2CO3, растворимый вHNO3и разлагающийся при кипячении в воде до темного осадкаAg2Oи СО2:
Ag2CO3→Ag2O+ СО2
|
из
5.00
|
Обсуждение в статье: Классификация анионов, основанная на их окислительно-восстановительных свойствах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

