 |
Главная |
Группового реагента не имеется.
|
из
5.00
|
1. Аналитические реакции нитрит – иона NO2-.
Нитриты токсичны!
1. Реакция с дифениламином (фармакопейная).
Реакцию проводят в концентрированной серной кислоте. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
2С6Н5NHС6H5 → C6H5 – NH – C6H4 –C6H4 – NH – C6H5 + 2 H+ + 2ē
дифениламин дифенилбензидин (бесцветный)
Две молекулы дифениламина отдают окислителю два электрона и теряют два иона водорода. Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем до окрашенного в синий цвет дифенилдифенохинондиимина, при котором молекулы дифенилбензидина также отдает окислителю два электрона и теряет два иона водорода: 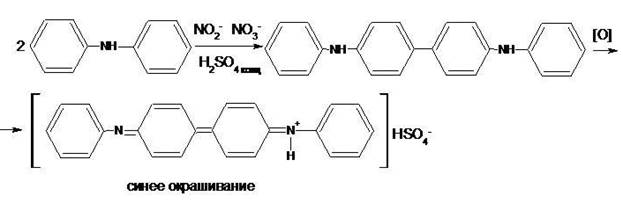
Признаки реакции: При стоянии синей смеси, ее окраска постепенно изменяется вначале на бурую, а затем – на желтую, вследствие необратимого разрушения синего продукта реакции.
Нитрат – ион NO3- дает аналогичную реакцию с дифениламином.
2. Реакция с сильными кислотами (фармакопейная).
NaNO2- + H С l ↔ HNO2 + Na С l
NO2- + H+ ↔ HNO2
2HNO2 → N2O3 + H2O → NO↑ + NO2↑ + H2O ( желто - бурые пары )
3. Реакция с иодидом калия (нитрит – ион – окислитель).
Нитрит – ион в кислой среде (HCl, H2SO4, CH3COOH) окисляет иодид – ионы до свободного иода:
2NaNO2+ 2 KI+ 4HCl→ I2 + 2 NO + 2 H2O+ 2 КС l+ 2NaCl
2 NO 2 - + 2 I - + 4 H + → I 2 + 2 NO + 2 H 2 O
Признаки реакции: Образующийся йод обнаруживают реакцией с крахмалом (по посинению раствора) или экстрагируя его органическим растворителем – бензолом, хлороформом (органический слой окрашивается в фиолетовый цвет).
Нитрат - ион NO3- не мешает проведению реакции, поэтому ионы NO2- можно открыть в присутствии нитрат – ионов.
4. Реакция с перманганатом калия (нитрит – ион – восстановитель).

5 NO2- + 2 MnO4- + 6 H+ → 5 NO3- + 2 Mn2+ + 3 H2O
Нитрат – ион NO3- не обесцвечивает раствор KMnO4 (отличие от нитрит – иона – фармакопейный тест).
Признаки реакции: Розовый раствор перманганата калия обесцвечивается.
5. Реакция с реактивом Грисса – Илотвая.
Реактив Грисса – Илотвая – смесь сульфаниловой кислоты HSO3C6H4NH2 c 1- нафтиламином С10Р7NH2. Реакцию проводят в нейтральных или уксуснокислых растворах.Образующаяся в кислой среде в присутствии нитрит – иона азотистая кислота HNO2реагирует с сульфаниловой кислотой, давая соль диазония:
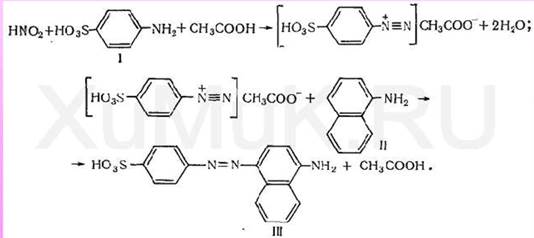
Признаки реакции: раствор окрашивается в красный цвет.
Нитрат – ион NO3- аналогичной реакции не дает.
Вместо сульфаниловой кислоты используют и другие ароматические амины, а вместо 1-нафтиламина – 1 амино – 2- нафтол, 2- нафтол и т.д.
6. Реакция с солями аммония – реакция разложения (удаления) нитрит ионов.
NO2- + NH4+ → N2 + 2 H2O
Аналогична реакция с карбамидом:
2 NO2- + 2 Н+ + СО (NH2)2 → 2 N2 + СО2 + 3 H2O
Эти реакции используют для удаления нитрит – ионов из раствора.
Признаки реакции: Наблюдается выделение пузырьков газа – азота.
7. Реакция с антипирином (фармакопейная).
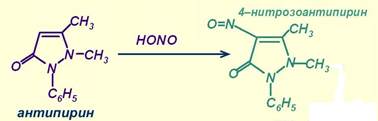
(изумрудно-зеленый)
Нитрит – ион с солями кобальта и KСl в уксуснокислой среде дает желтый кристаллический осадок гексанитрокобальтата (III) калия K3[Co(NO)2)6]; с FeSO4 в сернокислой или уксуснокислой среде образует комплекс состава [Fe(NO)SO4] бурого цвета и т.д.
Аналитические реакции нитрат – иона NO3-.
Нитрат – ион NO3- - анион одноосновной сильной азотной кислоты HNO3.
1. Реакция с дифениламином (фармакопейная).
Эта реакция – общая для NO3- и NO2- и проводится точно так же, как и для нитрит – иона ( выше); только вместо раствора нитрита натрия используют раствор нитрата натрия или калия. Данной реакцией нельзя открывать нитраты в присутствии нитритов.
2. Реакция с металлической медью (фармакопейная).
Реакцию проводят в среде концентрированной H2SO4 при нагревании.
2 NaNO3-+ 8 HCl + 3 Cu → 3 CuCl2 + 2 NO↑ + 4 H2O + 2NaCl
2 NO3- + 8 H+ + 3 Cu → 3 Cu2+ + 2 NO↑ + 4 H2O
2NO + O2 ↔ 2 NO2↑(желто-бурые пары)
3. Реакция с сульфатом железа (II) и концентрированной серной кислотой.
Реакцию проводят при нагревании:
2NaNO2 + 2FeSO4 + 2H2SO4 → Fe2(SO4)3 + 2NO + Na2SO4 + 2H2O
3 Fe2+ + NO3- + 4 H+ → 3 Fe3+ + NO + 2 H2O
Fe2+ + NO + SO42- ↔ [Fe NO]SO4 (бурый)
Эту реакцию дает и нитрит – ион, поэтому нельзя открыть этой реакцией нитрат – ион в присутствии нитрит – иона.
3. Реакция с металлическим алюминием или цинком.
3 NO3- + 8 Al + 5 OH- + 18 H2O → 3 NH3 + 8 [Al (OH)4]-
Признаки реакции: Выделяющийся аммиак ощущается по запаху и окрашивает влажную красную лакмусовую бумагу в синий цвет.
5. Реакция с антипирином.
Реакцию проводят в кислой среде.
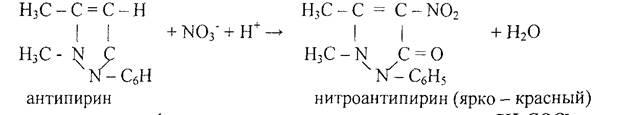
3. Аналитические реакции ацетат – иона СН3СОO-.
Ацетат – ион СН3СОО- - анион слабой одноосновной уксусной кислоты СН3СООН; в водных растворах бесцветен,
1. Реакция с хлоридом железа (III) (фармакопейная).
При рН = 5-8 ацетат – ион с катионами Fe(III) образует растворимый темно – красный (цвета крепкого чая) ацетат или оксиацетат железа (III).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
3 СН3СООН + Fe ↔ (CH3COO)3Fe + 3 H+
При кипячении из раствора выпадает красно-бурый осадок основного ацетата железа (III):
(CH3COO)3Fe + 2 H2О ↔ Fe(OH)2 СН3СОО + 2 СН3СООН
В зависимости от соотношений концентраций железа (III) и ацетат – ионов состав осадка может изменяться и отвечать, например, формулам:
FeOH(СН3СОО)2, Fe3(OH)2О3(СН3СОО), Fe3О(OH)(СН3СОО)6 или Fe3(OH)2(СН3СОО)7.
2. Реакция с серной кислотой.
Ацетат – ион в сильно кислой среде переходит в слабую уксусную кислоту, пары которой имеют характерный запах уксуса:
СН3СОО- + Н+ ↔ СН3СООН
3. Реакция образования уксусноэтилового эфира (фармакопейная).
Реакцию проводят в сернокислой среде. С этанолом:
СН3СОО Na + Н Cl ↔ СН3СООН
СН3СОО- + Н+ ↔ СН3СООН
СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О
Признаки реакции: Выделяющийся этилацетат обнаруживают по характерному приятному запаху.
Соли серебра катализируют эту реакцию, поэтому при ее проведении рекомендуется добавлять небольшое количество AgNO3.
Аналогично при реакции с амиловым спиртом С5Н11ОН образуется также обладающий приятным запахом амилацетат СН3СООС5Н11(«грушевая») Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.
|
из
5.00
|
Обсуждение в статье: Группового реагента не имеется. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

