 |
Главная |
Преимущества химические источников тока
|
из
5.00
|
· Портативность
· Бесшумность работы
· Процессы идут при температуре окружающей среды
· Без выделения веществ
В случаях, когда требуется получение большого количества энергии за короткое время, используют аккумуляторы, когда требуется ток малой величины и малое время, используют батарейки.
Химические источники тока подразделяются:
-- По назначению:
- Первичные (1 раз)® батарейки
- Вторичные (много)® аккумуляторы
-- По конструкции
- Элементы с загущенным электролитом (непролив.)
- Элементы с жидким электролитом (наливные)
-- По особенностям работы
- С твердыми окислителями
- Элементы воздушных систем
- Смешанные
Сухой элемент предложен Леклонше (1876г.) марганцево-цинковый элемент. Используется электролит в загущенном виде (загуститель крахмал вещества). Применяется для питания аппаратуры связи и бытовых приборов.
Анод – цинк
Катод – графитовый стержень с оксидом 4-х валентного марганца MnO2.
Электролитом является паста (хлорид аммония с добавлением муки или крахмала)
ZnúNH4ClúMnO2
A: Zn®Zn2++2e
2Zn2++NH4Cl®[Zn(NH3)4]Cl2+ZnCl2+4H+
K: Восстановление Mn4+ к Mn3+
MnO2+H++e®MnOOH
Суммарное уравнение токообразующей реакции
2Zn0+4MnO2+4NH4Cl®4MnOOH+ZnCl+[Zn(NH2)]Cl2
A K E=1,5B
Сухой кислородно-цинковый элемент
ZnúNH4ClúO2
Катодным деполяризатором является кислород воздуха, током отвода – активированный уголь, пропитанный водоотталкивающим веществом.
Катод – полый угольный цилиндр, внутренняя полость которого обеспечивает доступ кислорода. Снаружи он соприкасается с загущенным электролитом.
O2+2Zn+4NH4Cl®ZnCl2+[Zn(NH3)4]Cl2+2H2O
E=1,4B
Ртутно-цинковый
Катод – оксид ртути с графитом и запрессованный в отдельный корпус
Анод – цинковый порошок с добавкой 1% ртути, который запрессовывается в крошку электролита
Электролит – 40% гидроксид калия с добавкой 5% оксида цинка. Им пропитывают фильтрованную бумагу, которую помещают между электродами.
HgO+2KOH+Zn®K2ZnO2+H2O+Hg
E=1,34B
Элементы хранятся много лет и работают при температуре до 1300 и используется в приемниках, слуховых аппаратах и кардиостимуляторах.
Наливные
Можно увеличивать напряжение так как на аноде металл с более электроотрицательным потенциалом (Mg). Однако такие аноды в водных растворах окисляются, выделяя водород, что ведет к саморазряду аккумулятора при хранении. Поэтому разработаны элементы, которые хранятся в сухом виде и электролит заливают перед началом работы.
Свинцово-кадмиевый
CdúH2SO4úPbO2
PbO2+H2SO4+Cd®PbSO4+CdSO4+2H2O
E=2,2B
Аккумулятор – устройство, в котором происходит взаимные превращения электрической энергии в химическую и наоборот.
В них под действием внешнего источника тока накапливается химическая энергия, которая затем переходит в электрическую. Процесс накопления химической энергии называется зарядкой аккумулятора, процесс превращения химической энергии в электрическую – разрядкой.
При зарядке он работает как электролизер, при разрядке – гальванический элемент
Свинцовый
Электроды создаются заполнением решеток свинцовой решетки пастой из оксида 2-х валентного свинца. Электролит – 32% H2SO4 при погружении электродов в раствор H2SO4 происходит реакция
PbO+H2SO4®PbSO4¯+H2O
В этом состоянии оба электрода имеют один состав, окислительно-восстановительное взаимодействие невозможно, значит аккумулятор разряжен.
При зарядке через аккумулятор пропускают постоянный ток, и при этом протекает процессы электролиза. На катоде идет процесс восстановления свинца от +2 до 0
K: PbSO4+2H2++2e®Pb+H2SO4
Pb2++2e®Pb0
A: PbSO4+SO42+®Pb(SO4)2+2e
Pb2+®Pb4++2e
Pb(SO4)2+2H2O®PbO2+H2SO4
Таким образом, после разрядки один электрод представляет собой губчатый свинец (PbO2).
При работе аккумулятора (разрядке) процесс протекает в другом направлении
K: Pb4+O2+H2SO4®Pb(SO4)2+H2O
Pb4+(SO4)2+2H++2e®Pb2+SO4+H2SO4
Pb4++2e®Pb2+
A: Pb+SO42–®PbSO4+2e
Pb0®Pb2++2e
Pb+PbO2+2H2SO4«2PbSO4+2H2O
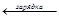 E=2,04B
E=2,04B
В конце заряда напряжение достигает значения диссоциации воды
K: 2H++2e®H20
A: 2H2O®O2+4H++4e
Разряжать аккумулятор следует до 1,7В, так как при этом на электродах образуется сульфат свинца (PbSO4) особой кристаллической структуры, которая изолирует активную массу электрода от электролита.
|
из
5.00
|
Обсуждение в статье: Преимущества химические источников тока |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

