 |
Главная |
Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе учения о строении атомов
|
из
5.00
|
При изучении неорганической химии вы ознакомились с открытием периодического закона Д.И. Менделеева и с данной им формулировкой этого закона. На основе теории строения атомов периодический закон Д.И. Менделеева формулируется так:
Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра атомов этих элементов.
Так теория строения атомов позволила уточнить формулировку периодического закона и более глубоко раскрыть его сущность.
Определение закономерностей размещения электронов по энергетическим уровням дало возможность выяснить сущность явления периодичности: с возрастанием заряда ядра атомов периодически повторяются сходные свойства элементов, атомы которых имеют одинаковое число валентных электронов.
Для создания современной теории строения атомов нельзя было объяснить и другие закономерности, проявляющиеся в периодическом законе и периодической системе химических элементов Д.И. Менделеева. Так, например, непонятно было, почему число элементов в периодах возрастает согласно ряду чисел 2–8–18–32, т.е. почему в 1-м периоде только два элемента, во 2-м и 3-м – по восемь, в 4-м и 5-м – по восемнадцать, а в 6-м – тридцать два. Нельзя было объяснить и сущность отличительных свойств элементов главных и побочных групп. Ответы на эти вопросы были получены только после выяснения состояния электронов в атомах, которые с учетом характера их движения и энергии делятся на s-, p-, d- и f-электроны. – электроны.
Основные сведения о s-, p- и d-электронах и s-, p- и d-элементах даны в курсе неорганической химии. s-Электронные облака имеют шаровую форму и, следовательно, занимают одно положение в пространстве. На s-орбитали может находиться не более двух электронов (если там находиться два электрона, то их спины противоположны), поэтому в 1-м периоде имеется всего два элемента – водород и гелий.

Рис. 1. Форма s-электронного облака
p-Электронное облако имеет гантелеобразную форму. При заданном квантовом числе таких облаков три. Они могут располагаться в трех взаимно перпендикулярных направлениях. А так как и p-электроны тоже отличаются своими спинами, то на данном энергетическом уровне может поместиться от одного до шести p-электронов.
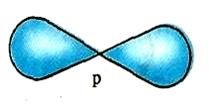
Рис. 2. Форма p-электронного облака
В соответствии с известной вам формулой N=2n² всего на втором энергетическом уровне может поместиться восемь электронов, два из которых являются s-электронами, а шесть – p-электронами. Этим и объясняется, почему во 2-м периоде может быть восемь элементов.
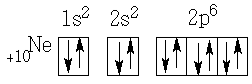
2-й период заканчивается элементом неоном Ne. Элементом неоном Ne заканчивается 2-й период и заканчивается заполнение электронами второго энергетического уровня.

3-период начинается одиннадцатым элементом – натрием Na. Так как второй энергетический уровень электронами уже заполнен, то с элемента натрия начинается заполнение третьего энергетического уровня. Оно протекает более сложно, ибо на нем в соответствии с формулой N=2n² может поместиться восемнадцать электронов.
Заполнение третьего энергетического уровня, начиная с одиннадцатого элемента – натрия Na до восемнадцатого элемента – аргона Ar, протекает аналогично заполнению электронами второго энергетического уровня. Девятнадцатый же электрон у элемента калия К и двадцатый электрон у элемента кальция Ca помещаются на четвертом энергетическом уровне, хотя третий энергетический уровень электронами еще не заполнен. Далее, у следующих по порядку десяти элементов, начиная от двадцать первого элемента – скандия Sc до тридцатого элемента – цинка Zn, следующие по порядку электроны помещаются на третьем энергетическом уровне. Этим завершается его заполнение до восемнадцати электронов.


Рис. 3. Возможные направления p-электронных облаков в пространстве.Может возникнуть вопрос: что представляет собой десять электронов, которыми заполняются энергетические уровни у атомов элементов от скандия до цинка? Оказывается, эти электроны при своем движении в области пространства образуют облака еще более сложной формы. Доказано, что такой формы облака располагаются в пространстве по пяти различным направлениям.
Учитывая, что электроны могут обладать противоположными (антипараллельными) спинами, их может быть в атомах от одного до десяти. Электроны с такой формой облаков называются d-электронами. Следовательно, на третьем энергетическом уровне может разместиться два s-электрона, шесть p-электронов и десять d-электронов, т.е. всего восемнадцать электронов.
|
из
5.00
|
Обсуждение в статье: Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе учения о строении атомов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

