 |
Главная |
Обсуждение результатов
|
из
5.00
|
Способность ионола и БФ образовывать водородные связи.
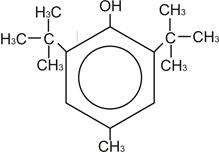
Ионол
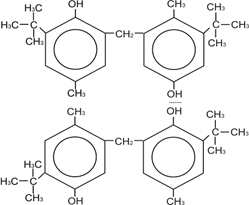 |
Димер
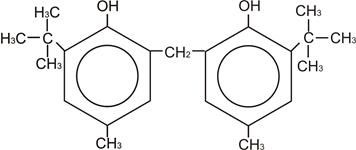 |
Цис-БФ
Ионол – это фенол, который в орто-положениях имеет трет-бутильные заместители и в пара-положении находится метил. Он способен к образованию внутримолекулярных и межмолекулярных водородных связей, так как он обладает таким свойством, как компланарность. Группа ОН (если рассматривать в трехмерном пространстве) находится в плоскости кольца и прикрыта трет-бутильными заместителями, которые затрудняют образование водородной связи. За счет того, что ОН-группа способна отклоняться от плоскости кольца, она может образовывать водородные связи.
Молекула БФ может находиться в цис-,транс-форме и в форме димера. В этой молекуле образование водородной связи осуществляется за счет возможности перехода одной конформации в другую, то есть за счет вращения относительно оси – СН2 – Цис-форма БФ образует внутримолекулярные водородные связи (как показано на рисунке). Если молекула цис-БФ перейдет в транс-форму, то ОН-группы окажутся по разные стороны относительно оси – СН2 – и становиться возможным образование межмолекулярной водородной связи, то есть образования димера БФ. В молекуле БФ, также как и в молекуле ионола в орто-положениях находятся трет-бутильные заместители, которые также затрудняют взаимодействие ОН-групп, но благодаря тому, что БФ может находиться в транс-форме, возможно образование межмолекулярной водородной связи.
1. Рассмотрим рисунок 3.
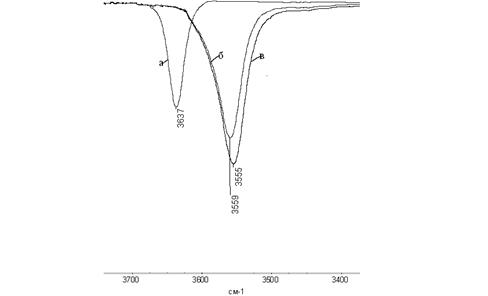
Рис. 3 - Фрагменты ИК спектров растворов ионола (а), п-крезола (б), фенола (в) в бензоле
Видно, что полоса поглощения ионола смещена в область высоких частот (3673 см-1), но обладает наименьшей оптической плотностью, пара-крезол находится правее (3559 см-1), но оптическая плотность больше, чем у ионола и фенола еще более смещен в область низких частот: относительно ионола на 82 см-1 , а относительно спектра пара-крезола на 4 см-1 – незначительно.
Во всех трех системах идет взаимодействие с π-электронной плотностью бензола. Легче всего образуется водородная связь с фенолом, так как взаимодействие ничем не затруднено из-за отсутствия посторонних заместителей. Видно, что у спектра(в) самая большая оптическая плотность и сдвиг в низкочастотную область, так как в растворе образуется большое количество ассоциатов.
В паракрезоле в параположении находится СН3 – группа, которая увеличивает электронную плотность кольца за счет положительного мезомерного и индуктивного эффектов, что оказывает влияние на реакционную способность ОН-группы. Из рисунка 3 видно, что количество ассоциатов уже меньше и пик сдвинут значительно в область низких частот. Аналогично из спектра ионола видно, что ассоциатов небольшое, так как образование водородной связи затруднено трет-бутильных заместителей.
2. Рассмотрим рисунок 1.
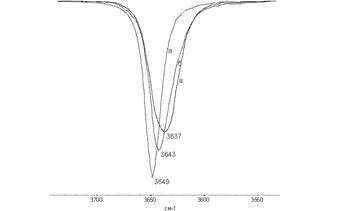
Рис.1 - Фрагменты ИК спектров растворов ионола в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Из рисунка видно влияние природы растворителя на способность к образованию водородной связи с ионолом. В четыреххлористом углероде водородная связь с ионолом не образуется, так как растворитель инертный в силу отсутствия протонов. С хлороформом, благодаря наличию одного протона происходит взаимодействиеполоса поглощения смещена на 6 см-1 в низкочастотную область и наблюдается уширение спектра, что также связано с образованием водородной связи. В растворе бензола также происходит образование водородной связи между растворителем и веществом, и пик еще менее острый и с более низкой оптической плотностью ИК-поглощение свободных ОН-групп, что также говорит об увеличении доли ассоциатов в растворе.
Таблица 1 - Характеристика ИК полос поглощения гидроксильных групп растворов ионола
| Растворитель | ν, см-1 | Оптическая плотность ИК поглощения ОН своб. |
| Четырёххлористый углерод ( CCl 4 ) | 3649 | 0,34 |
| Хлороформ ( CHCl 3 ) | 3643 | 0,29 |
| Хлористый метилен (СН2 Cl 2 ) | 3638 | 0,24 |
| Бензол (C 6 H 6 ) | 3637 | 0,23 |
| Толуол ( C 7 H 8 ) | 3637 | 0,23 |
| Кумол ( C 9 H 12 ) | 3643 | 0,19 |
| Примечание: ν – частота максимума полосы поглощения в ИК спектрах растворов ионола в области валентных колебаний ОН-группы | ||
Из таблицы 1 видно, что при растворении ионола в бензоле и толуоле частота и оптическая плотность одинаковы. Возможно, это связано с недостаточной чувствительностью прибора, так как СН3-группа влияет на электронную плотность кольца за счет положительных мезомерного и индуктивного эффектов.
3. Рассмотрим рисунок 2.
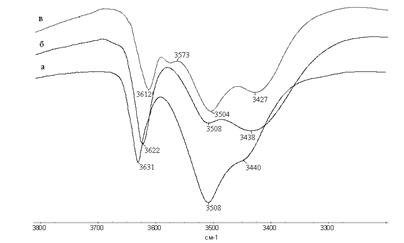
Рис. 2 – Фрагменты ИК спектров растворов БФ в четыреххлористом углероде (а), в хлороформе (б) и бензоле (в).
Таблица 2 - Характеристика ИК полос поглощения гидроксильных групп растворов БФ
Растворитель
ν, см-1
|
из
5.00
|
Обсуждение в статье: Обсуждение результатов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

