 |
Главная |
Теоретические основы процессов
|
из
5.00
|
В данном разделе изложено влияние основных параметров на выход и качество конечного продукта, которая представлена в виде условной графической схемы химических превращений при положении сульфата магния семиводного на рис. 2.1.
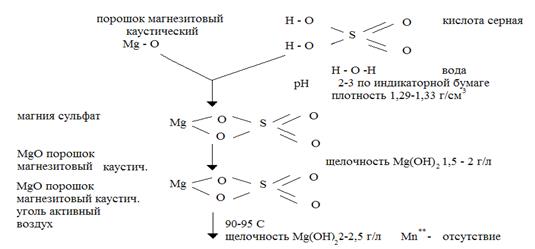

Рис. 2.1 – Химическая схема производства сульфата магния фармакопейного
Характеристика сырья и готовой продукции
В разделе рассмотрим физико-химические свойства сырья и готовой продукции, требования межгосударственных (ГОСТ) стандартов на изготовляемое вещество, которое представлено в таблице 2.2
Таблица 2.2 Характеристика сырья вспомогательных материалов и готовой продукции
| Наименование | Обозначение НД | Сорт и артикул | Показатели, обязательные для проверки | Примечание | |||||||||||
| 1. Кислота серная реактивная | ГОСТ 4204–77 | Квалификация «ч» | Внешний вид – маслянистая, слегка желтоватая, вязкая жидкость. |
| |||||||||||
| Массовая доля серной кислоты | |||||||||||||||
| Массовая доля остатка после прокаливания, % не более – 0,005 | |||||||||||||||
| Массовая доля хлоридов | |||||||||||||||
| Массовая доля нитратов | |||||||||||||||
|
|
|
| Массовая доля аммонийных солей |
| |||||||||||
| Массовая доля тяжелых металлов | |||||||||||||||
| Массовая доля железа | |||||||||||||||
| Массовая доля мышьяка | |||||||||||||||
| Массовая доля селена (Se), %, не более 0,0005 | |||||||||||||||
| Массовая доля моногидрата (H2SO4), % не менее 92,5 | Раствор магния сульфата | ||||||||||||||
| 3. Кислота серная техническая | ГОСТ 2184–77 | Сорт 1,2 | Массовая доля моногидрата (H2SO4), % | 1-й сорт не менее 92,5 | 2-ой сорт не менее 92,5 | – «»-
| |||||||||
| Массовая доля железа (Fe), %, не более | 0,02 | 0,1 | |||||||||||||
|
|
| Массовая доля остатка после прокаливания | 0,05 | не нормируются |
| ||||||||||
| 4. Порошок магнезитовый каустический | ГОСТ 1216–87
| ПМК-75 ПМК-83 ПМК-87 | Массовая доля на абсолютно | ПМК-87 87 1.8 1.8 | ПМК-83 83 2.5 2.5 | ПМК-75
75 4.5 3.5 | – «»- | ||||||||
Операционное описание технологического процесса
Технологический процесс производства магния сульфата состоит из следующих стадий:
– подготовка воды очищенной;
– санитарная подготовка производства;
– получение раствора магния сульфата;
– фильтрация раствора магния сульфата;
– очистка раствора магния сульфата от примесей железа и марнанца;
– упарка раствора магния сульфата;
– охлаждение раствора магния сульфата;
– кристаллизация магния сульфата;
– центрифугирование;
– сушка магния сульфата;
– фасовка и упаковка готово продукции;
Сущность процесса получения магния сульфата заключается во взаимодействии каустического магнезита с серной кислотой:
 (2.3.1)
(2.3.1)
Наряду с основными реакциями протекают следующие побочные реакции:
 (2.3.2)
(2.3.2)
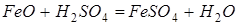 (2.3.3)
(2.3.3)
 (2.3.4)
(2.3.4)
Содержания каждой стадии технологического процесса, представлена в виде блок схемы на рис. 2.3.
Расчетная часть
Материальные расчеты
Порошок магнезитовый каустический
I. Теоретический расход МgО 100% на 1 т 99,5% МgSО4. 7Н2О
МgО + Н2SО4 + 6Н2О = МgSО4. 7Н2О (3.1.1)
40,31 98 246,46
40,31. 99,5. 1000 = 162,74 кг,
246,46. 100
где: 40,31 – молекулярная масса МgО;
246,46 – молекулярная масса МgSО4. 7Н2О;
99,5 – массовая доля МgSО4. 7Н2О в готовом продукте, %.
II. Потери:
1. Со шламом после чистки осадителей:
а) в виде МgSО4. 7Н2О в пересчете на МgО:
40,31. 60. 5 = 0,49 кг,
246,46. 100
где: 60 – количество шлама на 1 т продукта, кг;
5 – массовая доля МgSО4. 7Н2О в шламе, %;
б) в виде МgО:
60. 12 =7,2 кг
100
где: 12 – массовая доля МgО в шламе, %.
Всего: 0,49 + 7,2 = 7,69 кг
2. Со шламом с фильтра ЛГ-40 после холодильников в виде МgSО4. 7Н2О в пересчете на МgО:
40,31. 40. 20 =1,31 кг,
246,46. 100
где: 40 – количество шлама на 1 т продукта, кг;
20 – массовая доля МgSО4. 7Н2О в шламе, %;
3. Со шламом при чистке уварителей в виде МgSО4. 7Н2О в пересчете на МgО:
40,31. 60. 15 =1,47 кг,
246,46. 100
где: 60 – количество шлама на 1 т продукта, кг;
15 – массовая доля МgSО4. 7Н2О в шламе, %.
4. Со шламом с фильтра КМП-25
а) в виде МgSО4. 7Н2О в пересчете на МgО:
40,31. 100. 10 =1,64 кг,
246,46. 100
где: 100 – количество шлама на 1 т продукта, кг;
10 – массовая доля МgSО4. 7Н2О в шламе, %.
б) в виде МgО:
100. 6 =6 кг,
100
где: 6 – массовая доля МgО в шламе, %;
Всего: 1,64 + 6 = 7,64 кг
5. Со слабым маточным раствором в пересчете на МgО, откачиваемым в трехкаскадный отстойник:
20. 1,65. 40,31 =5,40 кг,
246,46
где: 20 – массовая концентрация МgSО4; 7Н2О, г/дм3;
1,65 – объем маточного раствора, м3.
6. При транспортировке и растворении порошка магнезитового – 1,5%
162,74 х 0,015 = 2,48 кг
7. При транспортировке и упаковке готового продукта – 2%, что в пересчете на МgО составит:
1000. 0,02. 40,31 =3,27 кг
246,46
Показатели по порошку магнезитовому каустическому магния на 1 т сульфата магния фармакопейногоприведена в таблице 3.1.1
Таблица 3.1.1 Материальный баланс порошка магнезитового каустического магния
Приход
Расход


 , % не менее -93,6–95,6
, % не менее -93,6–95,6 , %, не более – 0,00010
, %, не более – 0,00010 , %, не более -0,00050
, %, не более -0,00050 , %, не более – 0,0005
, %, не более – 0,0005 , %, не более – 0,0005
, %, не более – 0,0005 , %, не более – 0,00030
, %, не более – 0,00030 , %, не более – 0,000010
, %, не более – 0,000010 / 9 /
/ 9 / MgO = 601,7
MgO = 601,7  / 9 /
/ 9 / , (3.2.2)
, (3.2.2) - это вес исходного раствора в кгс;
- это вес исходного раствора в кгс; ; / 9 /
; / 9 / =10067,3 кДж (3.2.3)
=10067,3 кДж (3.2.3) =31809,5Дж (3.2.4)
=31809,5Дж (3.2.4) =18320,4кДж (3.2.5)
=18320,4кДж (3.2.5) (3.2.6)
(3.2.6) (3.2.7)
(3.2.7) (3.2.9)
(3.2.9)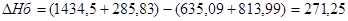 (3.2.11) FeO + H2SO4 = FeSO4 + H2O (3.2.12)
(3.2.11) FeO + H2SO4 = FeSO4 + H2O (3.2.12) (3.2.13)
(3.2.13) (3.2.14)
(3.2.14) (3.2.15)
(3.2.15) - это вес маточного раствора;
- это вес маточного раствора; кДж (3.2.16)
кДж (3.2.16) кДж (3.2.17)
кДж (3.2.17)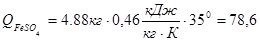 кДж (3.2.18)
кДж (3.2.18) (3.2.19)
(3.2.19)  кДж/моль (3.2.20)
кДж/моль (3.2.20)