 |
Главная |
Теоретические и экспериментальные изотермы реального газа. Метастабильные состояния.
|
из
5.00
|
Экспериментальные и теоретические изотермы для реальных газов. Критическая точка
Впервые экспериментальные изотермы для реальных газов (углекислый газ 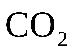 ) были изучены Эндрюсом, они были получены медленным изотермическим сжатием ненасыщенного пара, находящегося в цилиндре под поршнем (изотермы приведены на рис. 2.19,а).
) были изучены Эндрюсом, они были получены медленным изотермическим сжатием ненасыщенного пара, находящегося в цилиндре под поршнем (изотермы приведены на рис. 2.19,а).
Как видно из изотерм, приведенных на рис. 2.19,а, все они содержат горизонтальный участок, который с повышением температуры уменьшается и при достижении критической температуры ( 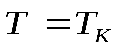 ) полностью исчезает. Критической температуре соответствует критическая изотерма 4, на ней в критической точке имеется точка перегиба.
) полностью исчезает. Критической температуре соответствует критическая изотерма 4, на ней в критической точке имеется точка перегиба.
Если провести через крайние точки горизонтальных участков изотерм линию (она будет колоколообразной), то тогда вся область диаграммы в координатах ( 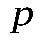 ,
, 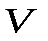 ) будет разделена на три области (рис. 2.19,б) - область жидких состояний, область газообразных состояний и область двухфазных состояний (в ней одновременно существуют газообразное и жидкое состояния вещества). Отметим, что на рис. 2.19,б не отражено твердое состояние вещества.
) будет разделена на три области (рис. 2.19,б) - область жидких состояний, область газообразных состояний и область двухфазных состояний (в ней одновременно существуют газообразное и жидкое состояния вещества). Отметим, что на рис. 2.19,б не отражено твердое состояние вещества.
Область газообразных состояний, которая располагается выше критической изотермы, называют газом. Изотермы в этой области напоминают изотермы идеального газа (рис. 2.19,а, изотерма 5). В этой области температур вещество существует только в газообразном состоянии при любых давлениях и объемах, т.е. проводя изотермическое сжатие газа, нельзя его при таких температурах превратить в жидкость. Это объясняет тот факт, что гелий и водород длительное время с помощью процесса изотермического сжатия не удавалось перевести в жидкое состояние (для гелия и водорода критические температуры составляли 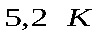 и
и 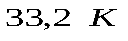 соответственно). Если взять газ, находящийся ниже критической изотермы, то при изотермическом сжатии его можно превратить в жидкость. Поэтому, отмечая этот факт, в этой области газ называют ненасыщенным паром.
соответственно). Если взять газ, находящийся ниже критической изотермы, то при изотермическом сжатии его можно превратить в жидкость. Поэтому, отмечая этот факт, в этой области газ называют ненасыщенным паром.
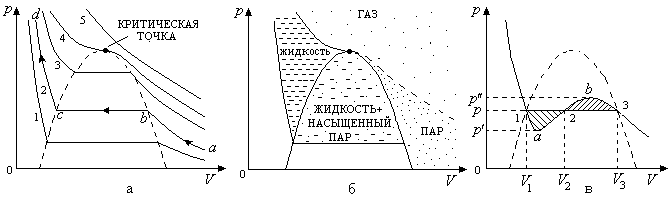
Рис. 2.19
Рассмотрим подробнее изотерму под номером 2 на рис. 2.19,а. Ее можно разделить на три участка.
Участок  -
- 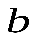 . При сжатии ненасыщенного пара он переходит в насыщенное состояние в точке
. При сжатии ненасыщенного пара он переходит в насыщенное состояние в точке 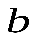 .
.
Участок 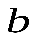 -
- 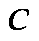 . Происходит конденсация насыщенного пара, при неизменном давлении, равном давлению насыщенного пара при данной температуре. В этой области объемов две фазы вещества – жидкая и парообразная – находятся в равновесии. При достижении точки
. Происходит конденсация насыщенного пара, при неизменном давлении, равном давлению насыщенного пара при данной температуре. В этой области объемов две фазы вещества – жидкая и парообразная – находятся в равновесии. При достижении точки 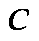 весь пар превращается в жидкость.
весь пар превращается в жидкость.
Участок 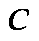 -
- 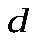 . Здесь наблюдается жидкое состояние вещества. Изменение объема жидкости при увеличении ее давления будет незначительным. Поэтому изотермы в этой области практически вертикальны.
. Здесь наблюдается жидкое состояние вещества. Изменение объема жидкости при увеличении ее давления будет незначительным. Поэтому изотермы в этой области практически вертикальны.
Рассмотрим подробнее, что происходит в критической точке (параметры, соответствующие ей, обозначаются как 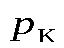 ,
, 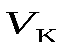 и
и 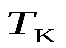 ).
).
В критической точке наблюдается критическое состояние вещества, для него исчезает различие между жидкостью и насыщенным паром. Это проявляется в том, что при нагреве в закрытом сосуде какой-то жидкости при достижении критической температуры исчезнет граница раздела между жидкостью и паром - они образуют единое однородное вещество (плотности пара и жидкости совпадут, силы поверхностного натяжения исчезнут, теплота парообразования будет равна нулю).
3. Сравнение теоретических и экспериментальных изотерм. Рассмотрим вид расчетных изотерм, которые можно получить из уравнения (2.86). Для этого перепишем это уравнение в следующем виде:
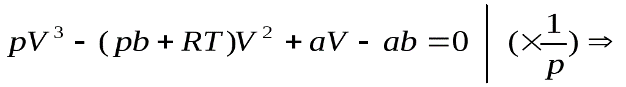
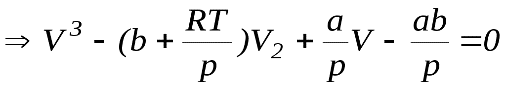 . (2.88)
. (2.88)
Известно, что такое кубическое уравнение имеет либо один, либо три вещественных корня. На рис. 2.19,в приведен график одной из расчетных изотерм - для нее в области давлений ( 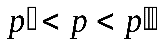 ) решение уравнения (2.88) дает три вещественных корня (горизонтальная линия
) решение уравнения (2.88) дает три вещественных корня (горизонтальная линия 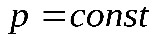 пересекает изотерму в трех точках, соответствующих значениям объема
пересекает изотерму в трех точках, соответствующих значениям объема 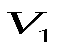 ,
, 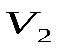 и
и 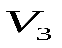 ). Это приводит к зигзагообразному (волнообразному) поведению изотермы в области одновременного существования насыщенного пара и жидкости.
). Это приводит к зигзагообразному (волнообразному) поведению изотермы в области одновременного существования насыщенного пара и жидкости.
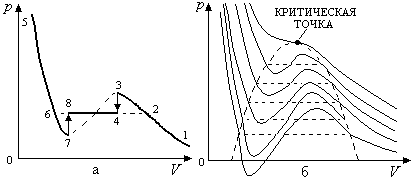
Рис. 2.20
Такое поведение изотермы в этой области не согласуется с экспериментом. В других же областях, где существует только жидкость или только пар, наблюдается достаточно удовлетворительное согласие между экспериментом и теорией.
Отметим, что волнообразные участки расчетных изотерм частично подтверждаются экспериментом. Если создать условия, при которых в газе будут отсутствовать центры конденсации (например, пылинки или ионы), то медленным изотермическим сжатием (переход 1-2-3) можно получить так называемый пересыщенный пар, ему соответствуют на изотерме состояния, заключенные между точками 2 и 3 (рис. 2.20,а). Давление пересыщенного пара превышает давление насыщенного пара при этой температуре. Эти состояния будут метастабильными (малоустойчивыми) – при возникновении центров конденсации пересыщенный пар быстро превращается в жидкость (переход 3-4), возникает равновесное состояние между насыщенным паром и жидкостью.
Аналогично можно получить метастабильные состояния перегретой жидкости. Для этого необходимо удалить из жидкости и стенок сосуда, в которой она находится, центры парообразования (например, пылинки, пузырьки растворенных в жидкости газов). Перегретой жидкости соответствуют состояния, расположенные на изотерме между точками 6 и 7, (рис. 2.20,а), ее температура будет выше температуры точки кипения. Если в жидкости возникают центры парообразования, то она мгновенно закипает (переход 7-8).
Состояния, соответствующие части изотермы между точками 3 и 7 (они обозначены пунктирной линией), абсолютно неустойчивы (рис. 2.20,а) и не реализуются на практике.
Для примера, на рис. 2.20,б приведены графики расчетных изотерм при различных температурах. При их построении необходимо учитывать, что площади фигур 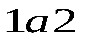 и
и 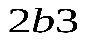 должны быть одинаковы (рис. 2.20,в), это является следствием второго начала термодинамики.
должны быть одинаковы (рис. 2.20,в), это является следствием второго начала термодинамики.
4. Критические параметры вещества. Рассмотрим, как с помощью экспериментально определенных критических параметров вещества ( 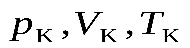 ), соответствующих критической точке, можно оценить постоянные
), соответствующих критической точке, можно оценить постоянные 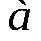 и
и 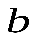 , входящие в уравнение Ван-дер-Ваальса.
, входящие в уравнение Ван-дер-Ваальса.
Критической точке на критической изотерме соответствует точка перегиба, причем в этой точке касательная к графику будет горизонтальна. Это означает, что в этой точке равны нулю первая и вторая производные давления газа по объему. Найдем эти производные. Для этого перепишем уравнение (12.99) в следующем виде:
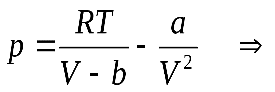
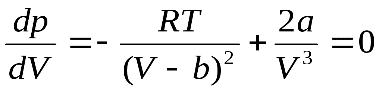 ,
, 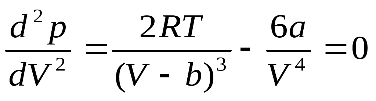 .
.
Решая эти алгебраические уравнения, получим
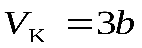 ,
, 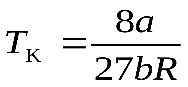 ,
, 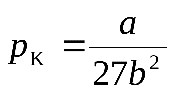 , (2.89)
, (2.89)
что позволяет записать уравнения состояния вещества в критической точке в следующем виде (для одного моля вещества):
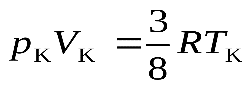 .
.
В отличие от уравнения Менделеева – Клапейрона здесь в уравнение входит коэффициент 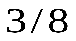 , что связано с существенным взаимодействием молекул друг с другом.
, что связано с существенным взаимодействием молекул друг с другом.
В качестве примера можно привести критические параметры состояния для некоторых веществ - гелий ( 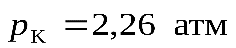 ,
, 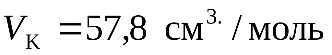 ,
, 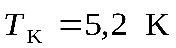 ), углекислый газ (
), углекислый газ ( 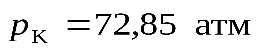 ,
, 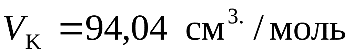 ,
, 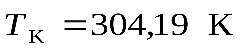 ), вода (
), вода ( 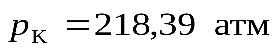 ,
, 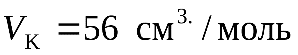 ,
, 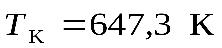 ).
).
Критические параметры позволяют провести расчет параметров 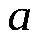 и
и 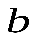 , входящих в уравнение Ван-дер-Ваальса. Например, для углекислого газа параметры
, входящих в уравнение Ван-дер-Ваальса. Например, для углекислого газа параметры 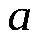 и
и 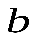 будут равны:
будут равны: 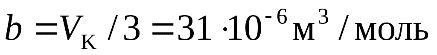 или
или 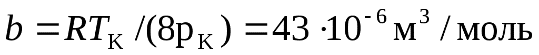 ;
; 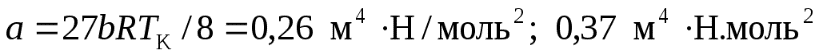 .
.
Видно, что использование разных формул для параметра 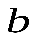 приводит к разбросу числовых значений параметров
приводит к разбросу числовых значений параметров 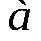 и
и 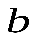 .
.
|
из
5.00
|
Обсуждение в статье: Теоретические и экспериментальные изотермы реального газа. Метастабильные состояния. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

