 |
Главная |
Тема «Окислительно-восстановительные реакции»
|
из
5.00
|
Окислительно-восстановительными или редокс-реакциями называют реакции, в которых меняется степень окисления элементов, входящих в состав реагирующих веществ. Процессы окисления-восстановления протекают одновременно, если одно из соединений, участвующих в реакции, окисляется, то другое восстанавливается.
Окислитель – это вещество, которое принимает электроны, в результате его степень окисления понижается:
Окислитель, Sn+4++2e→Sn2+ , процесс восстановления.
Окислители.
K2Cr2O7, KMnO4, Na2SO4, FeCl3, SnCl4, Cl20, Br20, I20, KIO4, KIO3 - и другие.
Реакция, в результате которой вещество принимает электроны, называется, наоборот, реакцией восстановления.
Восстановитель отдает электроны, степень окисления его повышается:
Восстановитель Cu+-le→Cu2+, процесс окисления.
Восстановители – все Me0, CrCl3,CrO, MnCl2, FeCl2, NaCl, KBr, Na2S, Na2SO3 и другие.
Реакция, в результате которой вещество отдает электроны, называется окислением.
Составление уравнений ОВР методом ионно-электронного баланса
(методом полуреакций)
Этот метод хотя и более длителен, чем метод электронного баланса, который изучается в школе, но он более точен, учитывает реально существующие частицы в растворе, которые могут подвергаться диссоциации. Если вещество мало растворяется или не диссоциирует совсем, является слабым электролитом, оксидом, газом, то их в уравнении реакции берут полностью, ставя общий заряд молекулы = 0.
Например: H2S0, H2O0, Fe(OH)30↓, Mn(OH)20↓, MnO20, CO20, NO0, Cl20, I20 и т.д.
Алгоритм:
1. Написать выражение уравнения ОВР в диссоциированном виде;
2. Выписать пары ионов, меняющих свою степень окисления;
3. Уравнять в обеих частях количество основного элемента;
4. Уравнять в обеих частях содержание кислорода и водорода по специальной таблице ниже;
5. Уравнять заряды обеих частей;
6. Сложить эти оба уравнения, умножив на коэффициенты;
7. Сократить подобные члены в левой и правой частях уравнения;
8. Подставить найденные коэффициенты в уравнение.
Подбор коэффициентов в О.В.Р.
| H+- среда | OH- - среда | H2O- среда | |||
| Не хватает кислорода | Противополож-ная сторона | Не хватает кислорода | Противоположная сторона | Реакция окисления - +ne | Реакция восстановле-ния -ne |
| + n H2O0 | +2nH+ | +2nOH- | +nH2O0 | как H+-среда | как OH- - среда |
n –число атомов кислорода, которого не хватает в одной из сторон.
В кислой среде:
В ту часть уравнения, где не хватает (О), записать необходимое число молекул H2O (столько молекул H2O, сколько не хватает атомов O), а в противоположную часть уравнения дописать соответствующее число ионов водорода (вдвое больше, чем молекул воды, т.к. в одной молекулы воды содержится 2 атома водорода).
В щелочной среде:
В ту часть уравнения, где не хватает кислорода, записать удвоенное число ионов гидроксония OH- (вдвое больше, чем недостающее число атомов кислорода), а в противоположную сторону уравнения дописать необходимое число молекул воды, (столько молекул воды, сколько не хватает атомов кислорода).
В нейтральной среде:
Уравнение реакции окисления уравнивается по кислой среде.
Уравнение реакции восстановления уравнивается по щелочной среде.
Примеры составления уравнений ОВР методом ионно-электронного баланса
(методом полуреакций)
Кислая среда:
KMnO4+Na2SO3+H2SO4→MnSO4+Na2SO4+K2SO4+H2O
K++MnO4-+2Na++SO32-+2H++SO42- →Mn2++SO42-+2Na++SO42-+2K++SO42-+H2O0
MnO4-→Mn2+
SO32-→SO42-
| 2 5 |
MnO4-+8H+→+5ē→ Mn2++4H2O0восстановление, окислитель
(+7) (+2)
SO32-+H2O0→-2ē→ SO42-+2H+окисление, восстановитель
(-2) (0)
-------------------------------------------------------------------------------------
2MnO4-+16H++5SO32-+5H2O→2Mn2++8H2O0+5SO42-+10H+
2Mn04-+6H++5SO32-→2Mn2++3H2O0+5SO42-
Коэффициенты из этой полуреакции переносятся в основное уравнение:
2KMnO4+5Na2SO3+3H2SO4=2MnSO4+5Na2SO4+K2SO4+3H2O
В кислой среде уравнивается следующим образом: в ту часть, где не хватает кислорода, вводят это же количество молекул воды, а в противоположную сторону водят удвоенное число (от того, сколько ввели воды) ионов H+:
MnO4-→Mn2++4H2O0
MnO4-+8H+→Mn2++4H2O0
Затем считаем суммарное число зарядов: слева (+7), а справа (+2), над строкой ставим нужное число электронов для уравнивания: чтобы из (+7) получить (+2) надо принять 5 электронов (+5ē):
MnO4-+8H+→+5ē→ Mn2++4H2O0
Щелочная среда:
KMnO4+Na2SO3+KOH→K2MnO4+Na2SO4+H2O
K++MnO4-+2Na++SO32-+K++OH- →2K++ MnO42-+2Na++SO42-+H2O
MnO4-→ MnO42-
SO32-→SO42-
В щелочной среде уравнивается так: в ту часть уравнения, где не хватает кислорода, вводят удвоенное число групп OH- , а в противоположную сторону – нужное количество молекул H2O
MnO4-→+1ē →MnO42-
(-1) (-2)
SO32-+2OH-→SO42-
SO32-+2OH-→SO42-+H2O0
(-4) (-2)
SO32-+2OH-→-2ē→ SO42-+H2O-
Или в конечном виде:
| 2 1 |
MnO4-→+1ē→MnO42-восстановление, окислитель
(-1) (-2)
SO32-+2OH-→-2ē→SO42-+H2O-окисление, восстановитель
(-4) (-2)
2Mn04-+SO32-+2OH-→2MnO42-+SO42-+H2O0
Итоговое уравнение будет:
2KMnO4+Na2SO3+2KOH=2K2MnO4+Na2SO4+H2O
Нейтральнаясреда:
KMnO4+Na2SO3+ H2O =MnO2+Na2SO4+KOH
K++MnO4-+2Na++SO32-+H2O0→MnO20+2Na++SO42-+K++OH-
MnO4-→ MnO20
В нейтральной среде реакция окисления уравнивается так же, как идет уравнивание кислой среды, а реакция восстановления – как щелочная среда. Так как 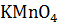 является окислителем, то это будет реакция восстановления, будем уравнивать как щелочную среду:
является окислителем, то это будет реакция восстановления, будем уравнивать как щелочную среду:
MnO4-→MnO20+4OH-
MnO4-+2H2O0→MnO20+4OH-
(-1) (-4)
MnO4- + 2H2O0→+3ē→ MnO20 + 4OH-
Na2SO3- это восстановитель, реакция окисления, будем уравнивать как кислую среду:
SO32- + H2O0 → SO42-
SO32- + H2O0 → SO42- + 2H+
(-2) (0)
SO32- + H2O→-2ē→ SO42- + 2H+
или:
SO32- + H2O →-2ē→ SO42- + 2H+ окисление, восстановитель 3
MnO 4 - + 2 H 2 O 0→+3ē→MnO 2 0 + 4 OH - восстановление, окислитель 2
3SO32- + 3H2O0 + 2MnO4- + 4H2O0 → 3SO42- + 6H+ + 2MnO20 + 8OH-
3SO32- + 2MnO4-+ 7 H2O0→ 3SO42- + 2MnO20 +6H2O0 + +2ОН-
Итоговое уравнение будет:
|
из
5.00
|
Обсуждение в статье: Тема «Окислительно-восстановительные реакции» |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

