 |
Главная |
Тема «Решение задач на точку эквивалентности», «Концентрация растворов»
|
из
5.00
|
Формулы титриметрического анализа
1. 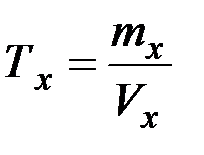


2. 

3. 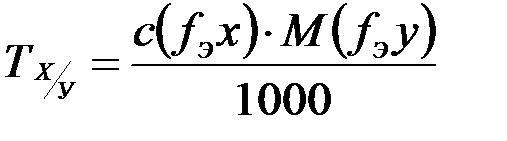


4. 


5. 

6. 

7. 

8. 

9.m(x)=C(fэх)•Vx(л)•M(fэx) 
10. 

11. С(х) = С(fэх) •fэкв =  12. С(fэх) =
12. С(fэх) =  = С(х) •
= С(х) • Z
13. С(х) = 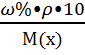 14. С(fэх) =
14. С(fэх) = 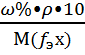
15. 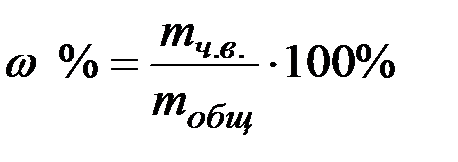
Концентрация растворов
Молярная концентрация, Cх моль/дм3, ммоль/см3 – отношение числа молей растворенного вещества к объему его раствора.
Сх=nх/V=mх/Мх*V
где : nх – количество растворенного вещества, моль,
V – объем раствора, дм3,
Мx – молярная масса вещества, г/моль
Этот термин распространяется на любой вид условных частиц (атомы, ионы, молекулы, частиц молекул и т.д.). В аналитической практике молярную концентрацию выражают в моль/дм3. Например, С(HCl)=0,01 моль/дм3;
С(H2SO4) = 0,2 моль/дм3 (разговорный термин – молярность). Краткое обозначение: 2м Н2SO4 или С( Н2SO4)=2моль/л.
С(fэх)  - молярная концентрация эквивалента: (разговорный термин – нормальность). Краткое обозначение: 2н Н2SO4 или С(fэ Н2SO4)=2моль/л.
- молярная концентрация эквивалента: (разговорный термин – нормальность). Краткое обозначение: 2н Н2SO4 или С(fэ Н2SO4)=2моль/л.
Массовая концентрация - это отношение массы растворенного вещества «m» к объему раствора «V», единицы измерения: кг/дм3, а также кратные и дольные единицы.
Массовую концентрацию, выраженную в г/см3 , называют титром (Тх). Эта единица дала название классическому методу анализа - титриметрия.
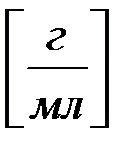
Титр вещества (Тх, г/см3) - это число граммов растворенного вещества (mx) в 1 см3 раствора : Тх=mх/Vx [г/см3] [г/мл]
Титр связан с молярной концентрацией эквивалента С(1/zX) формулой:
С(1/z(Х)=Тх*1000/М(1/z)Х и с молярной концентрацией раствора Сх: Тх=С(х)*М(х)/1000
При массовых анализах очень удобно выражать концентрацию выражаемых растворов через так называемый титр по определяемому веществу. Он показывает массу (г) определяемого вещества, которая соответствует 1 см3 рабочего раствора.
Титр по определенному компоненту связан с молярной концентрацией эквивалента раствора формулой:
Тх/y= с(1/z(Х)* М(1/z(Y)/1000
Например, титр рабочего раствора AgNO3, употребляемого при массовых определениях Cl-, обычно выражают по хлору , то есть указывают со сколькими граммами Cl- реагирует 1 см3 раствора AgNO3.
Зная молярную концентрацию эквивалента раствора, очень легко перейти к его титру по определяемому веществу. В данном случае, если молярная концентрация эквивалента раствора AgNO3 равна 0,1100 моль/дм3 , то 1 см3 его содержит 0,1100/1000 моль AgNO3 и реагирует с таким же количеством моль Cl-. А так как моль Cl- равен 35,45 г, то искомый титр AgNO3 по хлору
Т (AgNO3/Cl-),г/см3) равен:
Т(AgNO3/Cl-) =0,1100*35,46/1000=0,003901 [г/см3]
Моляльная концентрация - число моль растворенного вещества в 1000 г ( в 1кг) растворителя (м), (разговорный термин – моляльность)
Иногда концентрацию раствора выражают через плотность (  ):
): 
m=V×  ; V=m/r; r(H2O) =1 г/мл (г/см3) =1000кг/м3
; V=m/r; r(H2O) =1 г/мл (г/см3) =1000кг/м3
Вычисление молярной эквивалентной массы вещества
Вещества реагируют в эквивалентных количествах, то есть согласно закону эквивалентов. fэ=  , (fэ – фактор эквивалентности),
, (fэ – фактор эквивалентности),
где Z :
а) для кислот – число Н+, участвующих в реакции;
б) для оснований - число групп ОН-, участвующих в реакции;
в) для солей – произведение заряда Ме* число атомов Ме;
г) для ОВР – число nē (число отданных или принятых электронов).
М(fэx) = M*fэ =  [г/моль] - молярный эквивалент массы.
[г/моль] - молярный эквивалент массы.
Примеры определений молярных эквивалентных масс:
М(fэНCl)= 
М(fэH2SO4)=  - для реакции: H2SO4+2NaOH=Na2SO4 +2H2O
- для реакции: H2SO4+2NaOH=Na2SO4 +2H2O
М(fэ H2SO4)=  - для реакции: H2SO4 + NaOH=NaHSO4+ H2O
- для реакции: H2SO4 + NaOH=NaHSO4+ H2O
М(fэ NаOH)= 
М(fэBa(OH)2)=  - для реакции: Ba(OH)2+2НСl=BaCl2 + 2H2O
- для реакции: Ba(OH)2+2НСl=BaCl2 + 2H2O
М(fэBa(OH)2)=  - для реакции: Ba(OH)2+НСl=BaOHCl + H2O
- для реакции: Ba(OH)2+НСl=BaOHCl + H2O
М(fэCaSO4)=  ; М(fэK3PO4)=
; М(fэK3PO4)=  ; М(fэАlCl3)=
; М(fэАlCl3)=  ; М(fэKMnO4)=
; М(fэKMnO4)=  ; М(fэFe3(PO4)2)=
; М(fэFe3(PO4)2)= 
Для OBР:
KMnO4 ®+5ē®Mn2+ (в кислой среде); М(fэKMnO4)= 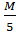
KMnO4 ®+1ē®K2MnO4 (в щелочной среде); М(fэKMnO4)= 
KMnO4 ®+3ē® MnO2 (в нейтральной среде); М(fэKMnO4)= 
Н2SO4 ®+8ē® H2S; М(fэН2SO4)=  ;
;
Решение задач.
Пример 1.
Навеску буры = 1,9070 г растворили в мерной колбе на 1л. Определить титр и молярную эквивалентную концентрацию буры.
Решение:
Na2B4O7 * 10H2O – бура
M(fэквбуры) = f(эквбуры) * M(буры) =M(буры)/2 = 190,7 г/моль;
Tбуры = m(x) / v(x) = 1,907 г / 1000 мл(см3) = 0,001907 г/мл(г/см3)
C(fэквбуры) = T(буры) * 1000 / M(fэквбуры) = 0,001907 * 1000 / 190,7 = 0,01 моль/л (моль/дм3).
Пример 2.
На титрование 25,00 мл (см3) 0,2000н (моль/л) (моль/дм3) раствора щавелевой кислоты (H2C2O4 * 2H2O) пошло 23,00 мл(см3) раствора KMnO4 в кислой среде. Определить  и C(fэквKMnO4).
и C(fэквKMnO4).
Решение:
По закону эквивалентов в Т.Э.:
C(fэквH2C2O4 * 2H2O) * V(fэквH2C2O4 * 2H2O) = C(fэквKMnO4) *  , отсюда
, отсюда
C(fэквKMnO4) = C(fэквH2C2O4 * 2H2O) * V(fэквH2C2O4 * 2H2O) /  = 25 * 0,2 / 23 = 0,21 моль/л(моль/дм3).
= 25 * 0,2 / 23 = 0,21 моль/л(моль/дм3).
 = С(fэквKMnO4) * M(fэквKMnO4) / 1000 = 0,21 * 31,6 / 1000 = 0,0066 г/мл
= С(fэквKMnO4) * M(fэквKMnO4) / 1000 = 0,21 * 31,6 / 1000 = 0,0066 г/мл
M(fэквKMnO4)= M(KMnO4)/5=158/5=31,6г/моль, т.к. в уравнении ОВР в кислой среде 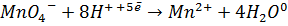
Пример 3:
Сколько граммов концентрированной H2SO4 надо взять для приготовления 5,00 литров 0,1000н (моль/л) (моль/дм3) раствора?
Решение:
C(fэквH2SO4) = 0,1 моль/л(моль/дм3).
M(fэквH2SO4) = M(H2SO4) * f(эквH2SO4) = M(H2SO4) /2= 98 /2 = 49 г/моль
m(x) = C(fэквx) * V(x) * M(fэквx) [г]
m(H2SO4) = C(fэквH2SO4) * V(H2SO4) * M(fэквH2SO4) = 0,1моль/л * 5 л* 49г/моль = =24,5 г – концентрированной H2SO4 надо взять.
Пример 4.
Определите w(%) HNO3 , если после растворения 2,1824г её в мерной колбе на 200,00мл (см3) на титрование 25,00мл(см3) 0,1000н(моль/л) (моль/дм3) раствора NaOH затрачено 26,30мл(см3) полученного раствора HNO3 .
Решение:
По закону эквивалентов: C(fэкв NaOH) * V(NaOH) = C(fэкв HNO3) *  ,
,
отсюда C(fэкв HNO3)=25*0,1/26,3=0,0951моль/л(моль/дм3).
mч.в.HNO3 =C(fэкв HNO3)* М(fэкв HNO3)* V (HNO3 )л =0,0951*63*0,2=1,1983(г)
М(fэкв HNO3)= М(HNO3)/1=1+14+16*3=63г/моль
V (HNO3 )=0,2л
w(%) HNO3 =mч.в.HNO3 *100% /mобщ.HNO3 =1,1983*100/2,1824=54,9 %
Пример 5.
Сколько граммов K2Cr2O7 содержится в растворе, если при добавлении к нему избытка KI и H2SO4 на титрование выделившегося йода расходуется 28,80 см3 раствора Na2S2O3. С(fэквNa2S2O3)=0,0200 н (моль/дм3)
Решение:
Определяем n (fэквNa2S2O3) = С (fэквNa2S2O3) *V = 28,8*0,02=0,576 ммоль. K2Cr2O7 участвует в ОВР в H+ - среде:
окислитель Cr2O7-2+14H+ →+6ē 2Cr3++7H2O ,реакция восстановления
Поэтому M(fэквK2Cr2O7) = М/6 = (39*2+52*2+16*7)/6=294/6=49 г/моль
По формуле определяем массу соли:
m(K2Cr2O7) = n(fэквK2Cr2O7)*M(fэквK2Cr2O7)/1000=0,576*49/1000=0,0282 (г)
Пример 6.
К 25,00 см3 0,0300 н (моль/дм3) раствора HCl прибавили 40,00мл (см3) 0,0200 н (моль/дм3) раствора NaOH. Определить pH и pOH полученного раствора. Что взято в избытке? Подобрать индикатор при этом случае титрования.
Решение:
n(fэHCl) = C*V = 25*0,03=0,75 ммоль
n(fэNaOH) = C*V = 40*0,02=0,8 ммоль --в избытке NaOH
[NaOH] = [OH-] = ∆n/∑v=(0,8-0,75)/(25+40) =0,05/65=0,00077=7,7*10-4моль/дм3
pOH = -lg7,7*10-4= -lg7,7- -lg10-4= -0,8865+4=3,1135
pH+pOH=14; → pH=14-3,1135=10,8865>7 среда раствора щелочная.
Подходит тот индикатор, в чей интервал перехода входит рассчитанные значения pH. Подходит индикатор:
| Ализариновый красный | Фиолетовый | 10,0-12,0 | Бледно-желтый |
| Ализариновый желтый | Светло-желтый | 10,1-12,1 | Коричнево оранжевый |
Пример 7.
2,3428 г технической соды Na2CO3растворили в мерной колбе на 250,00 см3. На титрование 25,00 см3 полученного раствора расходуется 24,50см3 раствора HCl. THCl = 0,003650г/см3. Определить массовую долю карбоната натрия в технической соде.
Решение:
С(fэHCl) = T(HCl)*1000/M(fэHCl) = 0,00365*1000/36,5=0,1моль/дм3
M(fэ HCl) = M/1= 1+35,5/1=36,5 г/моль;
по закону эквивалентов:
С(fэNa2CO3)*VNa2CO3= С(fэHCl)* VHCl; → С(fэNa2CO3) = 24,5*0,1/25=0,098 моль/дм3
mч.в.(Na2CO3)= С(fэNa2CO3)* VNa2CO3(дм3)*М(fэNa2CO3)
m (Na2CO3)=0,098*0,25*53=1,2985 (г)
М(fэNa2CO3)=М/2=(23*2+12+16*3)/2=106/2=53 г/моль
ω%(Na2CO3)= mч.в/ mобщ*100%= 1,2985*100/2,3428=55,43%
Пример 8.
0,6700 г оксалата натрия (Na2C2O4) растворили в мерной колбе на 500,00 мл (см3). Определить титр, молярную эквивалентную концентрацию соли и титр оксалата натрия по хлориду натрия.
Решение:
Т(Na2C2O4) = m/V=0,6700/500=0,00134 (г/см3)
C(fэ Na2C2O4) = Т*1000/М(fэ Na2C2O4)=0,00134×1000/67 = 0,02 (моль/дм3)
М(fэ Na2C2O4)=М/2 = (23×2+12×2+16×4)/2 = 134/2=67 (г/моль)
Т(Na2C2O4/NaCl) = C(fэ Na2C2O4)× М(fэ NaCl)/1000 = 0,02×58,5/1000 = 0,00117 (г/см3)
М(fэ NaCl) = M(NaCl)/1 = 23+35,5 = 58,5(г/моль)
Пример 9.
. На титрование 15,00 см3 раствора тетрабората натрия (Na2B4O7•10H2O) затрачено 12,25 см3 раствора соляной кислоты с молярной концентрацией эквивалента 0,1000 моль/дм3. Вычислить молярную концентрацию эквивалента тетрабората натрия и массу тетрабората натрия во взятом на титрование объёме раствора.
Решение:
1) По закону эквивалентов
: C(fэкв Na2B4O7•10H2O) * V(Na2B4O7•10H2O)) = C(fэкв HСl) * V(HСl)
Находим молярную концентрацию эквивалента тетрабората натрия, (моль/дм3):
C(fэкв Na2B4O7•10H2O) = 0,1000*12,25/15,00 = 0,0817 (моль/дм3)
2) масса тетрабората натрия во взятом на титрование объёме раствора (15,00 см3) равна( г):
m = C(fэкв HСl) * V(HСl)/ 1000 = 0,1000*12,25*190,7 = 0,2336г
Молярная масса эквивалента тетрабората натрия равна (г/моль):
М (fэкв Na2B4O7•10H2O) = М/2 = 381,27/2 = 190,69 = 190,7г/моль
|
из
5.00
|
Обсуждение в статье: Тема «Решение задач на точку эквивалентности», «Концентрация растворов» |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

