 |
Главная |
Тема «Ионизация. Водородный и гидроксильный показатели»
|
из
5.00
|
Тема «Произведение растворимости»
В процессе аналитических определений часто используют гетерогенные системы, т.е. системы, разграниченные поверхностями раздела. Осадок и насыщенный раствор представляют собой различные фазы гетерогенной системы.
Растворение малорастворимых электролитов в воде является обратимым процессом и подчиняется закону действия масс. Так, при соприкосновении кристаллов с водой, одновременно протекают два процесса: переход ионов соли в раствор и соединение ионов, находящихся в растворе, с кристаллами нерастворившегося соединения.
Так как данная система находится в состоянии равновесия, поэтому произведение концентраций ионов в насыщенном растворе труднорастворимого соединения является величиной постоянной при данной температуре и называется произведением растворимости и обозначается ПР с индексом электролита.
Например:
AgCl ↔ Ag+ +Cl-;
ПР(AgCl) = [Ag+]*[Cl-].
В общем случае: MemAnn↔ mMen+ +nAnm-
ПРMemAnn = [Men+]m*[Anm-]n.
Если произведение концентрации ионов труднорастворимого электролита меньше его произведения растворимости, раствор является ненасыщенным. В тот момент, когда ионное произведение достигает величины ПР данного электролита, раствор станет насыщенным относительно этого электролита. Если ионное произведение превышает величину ПР, раствор станет пересыщенным и начнется выпадения осадка. Для AgCl:
[Ag+] * [Cl-] < ПРAgCl (справочного значения)- ненасыщенный раствор;
[Ag+] * [Cl-] = ПРAgCl - насыщенный раствор;
[Ag+] * [Cl-] > ПРAgCl - пересыщенный раствор, выпадает осадок¯
Решение задач на произведение растворимости
Растворимость выражается:
S= S/M(x)=  → моль/л; S` = S*M(x) = моль/л * г/моль → г/л.
→ моль/л; S` = S*M(x) = моль/л * г/моль → г/л.
Алгоритм (схема) решения задач
| I тип По величине растворимости определить значение ПР р-ть + ПР = ? | II тип По величине ПР определить значение растворимости ПР + р-ть= ? |
| 1. Уравнение диссоциации вещества | 1. Уравнение диссоциации вещества |
| 2. Уравнение ПР | 2. Уравнение ПР |
| 3. Если растворимость дана в г/л, то делаем пересчет растворимости в моль/л через М(x). | 3. Растворимость s =>x (моль/л): [ион] = s*n = x*n = nx [ион/] = s*n = x*n = nx. |
| 4. Определяем концентрацию каждого иона по формуле: [ион] = s*n, [ион/] = s*n, где s – растворимость в моль/л; n–число ионов в уравнении диссоциации | 4. Подставляем найденные концентрации в уравнение ПР и определяем x =>S[моль/л], т.е. решаем уравнение с одним неизвестным. |
| 5. Решаем уравнение ПР. | 5. Если надо по условию задачи, то делаем пересчет растворимости из моль/л в г/л через М (x). |
Пример 1.
Определить, выпадет ли осадок, если смешали две соли с концентрациями ионов, равными: [Pb2+]=0,0008 моль/л =8*10-4 и [CO3 2-]=0,04 моль/л=4*10-2
Решение.
Определяем произведение ионов (ИП)= [Pb2+]*[CO3 2-]=8*10-4 *4*10-2 =32*10-6 =3,2*10-5 .
По справочнику определяем значение ПР для соли PbCO3 =7,5*10-14 .
Сравниваем значения ИП и ПР: ИП ? ПР ® 3,2*10-5 >7,5*10-14 .
Вывод: так как значение ИП > значения ПР, то раствор является пересыщенным, осадок выпадает.
Пример 2.
Вычисление произведения растворимости малорастворимого электролита по его растворимости.
Задача: в 200мл раствора содержится 0,008 г Fe(OH)3. Найти ПР.
Задача I типа.
Решение:
1).Fe(OH)3↓ ↔ Fe3++3OH-
2).ПРFe(OH)3 = [Fe3+]·[OH-]3=?
3).
200мл – 0,008г.
1000 мл – x г
или
0,2л – 0,008г.
1л – х г.
х=0,04 г/л
M(Fe(OH)3) = 56+17·3=107 г/моль
S(моль/л) = (0,04г/л)/(107г/моль) = 0,000373=3,73·10-4 моль/л
4).[Fe3+]=S·n= S·1=3,73·10-4·1=3,73·10-4
[OH-]=S·n= S·3=3,73·10-4 ·3=11,19·10-4=1,119·10-3моль/л
5).ПР=3,73·10-4·(1,119·10-3)3=5,22·10-13
Ответ: ПР(Fe(OH)3) = 5,22·10-13
Пример 2
Вычисление растворимости электролита в воде по известному произведению растворимости.
Задача II типа: ПР(Fe(OH)2) = 8·10-31. Найти растворимость Fe(OH)2 в г/л и в моль/л.
1).Fe(OH)2↓ ↔ Fe2++2OH-
2).ПР(Fe(OH)2) = [Fe2+]·[OH-]2 = 8·10-31
3).S→x
[Fe2+]=S·n=x·1=x
[OH-]=S·n=x·2=2x
4).
x·(2x)2 = 8·10-31
4x3=8·10-31
x3=2·10-31
x=3√(2·10-31)=3√(200·10-33)=5·10-11 моль/л
S=5·10-11 моль/л
5).M(Fe(OH)2) = 56+34= 90 г/моль
S` = S *М=5·10-11(моль/л)* · 90(г/моль) = 4,5·10-9 г/л
Ответ: Растворимость (Fe(OH)2) = 4,5·10-9 г/л и 5·10-11 моль/л
Тема «Ионизация. Водородный и гидроксильный показатели»
Реакции, применяемые в аналитической химии, протекают, как правило, в водных растворах. Вода относится к слабым электролитам и, хоть в незначительной степени, но подвергается ионизации: H2О↔H+ + OH-
При комнатной температуре в каждом литре воды лишь 1 * 10-7 моль молекул диссоциировано на ионы.
[H+]= [OH-]= 1 * 10-7моль/л
Произведение концентрацииионов H+ и OH- в воде и водных растворах является постоянной величиной при постоянной температуре. Эта величина называется ионным произведением воды Kw:
K (H2О) = const = Kw = [H+] * [OH-] = 1 * 10-14.
Вывод: как бы ни менялась концентрация ионов H+ и OH-, их произведение при температуре 22 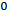 С всегда равно 1 * 10-14.
С всегда равно 1 * 10-14.
Чистая вода имеет нейтральную среду, следовательно, если:
[H+] = 1 * 10-7 моль/л – среда нейтральная;
[H+] > 1 * 10-7 моль/л – среда кислая;
[H+] < 1 * 10-7 моль/л – среда щелочная.
Применение чисел с отрицательными показателями степени затруднительно, поэтому были введены отрицательные десятичные логарифмы концентрации ионов водорода H+ и гидроксид-ионов OH-– ионов водорода и гидроксила, назвав их соответственно водородным (pH) и гидроксильным (pOH) показателями.
Водородный показатель рассчитывается по формуле: pH = -lg [H+]; [H+] = 10-рН
Гидроксильный показатель: pOH = -lg [OH-].
Из ионного произведения воды следует: pH + pOH = 14.
Кислотность растворов теперь тоже можно охарактеризовать количественно через величину pH:
- нейтральный раствор pH = 7
-кислый раствор pH< 7
- щелочной раствор pH> 7.
Из математики
Lg 0 - не существует; lg 1 = 0; lg 10 = 1 Þ
десятичный логарифм определяют по четырёхзначной математической таблице В.М.Брадиса для значений чисел >1, но <10, например:
lg 2,0 = 0,3010
lg 2,3 = 0,3617
lg 2,35 = 0,3711
lg 2,358 = 0,3726
lg 10+n = +n ; lg 10-n = -n ; - lg 10-n = +n
lg a · b = lg a + lg b
-lg a · b = -lg a – lg b
lg  = lg a – lg b
= lg a – lg b
-lg  = -lg a + lg b
= -lg a + lg b
Примеры решения задач:
Пример 1.
Решение:
В растворе содержится [H+] = 0,0048 моль/л. Определить pH, pOH, [OH-].
Охарактеризовать среду раствора.
Переводим 0,0048 = 4,8*10-3. pH= -lg [H+] =-lg4,8*10-3 = -0,68 + 3 = 2,32 <7, значит среда раствора кислая (здесь при решении используется таблица логарифмов).
pH + pOH = 14; pOH = 14 – pH = 14 – 2,32 = 11,68.
Так как [H+] * [OH-] = 1 * 10-14, то
[OH-] = 1*10-14 / 4,8*10-3 = 0,2*10-11 = 2*10-12моль/л.
Пример 2.
В растворе содержится [OH-]. = 0,003542 моль/л =3,542 * 10-3
Определить pH, pOH, [H+], характер среды
Решение:
[OH-] = -lg [OH-] = -lg3,542 * 10-3 = -lg 3,542 – lg10-3 = -0,5492 + 3 = 2,4508;
pH = 14 – 2,4508 = 11,5492 > 7, значит среда раствора кислая.
[H+] = 1*10-14/3,542*10-3= 0,282 *10-11 = 2,82 * 10-12 моль/л.
Пример 3.
В 250 мл раствора содержится 0,2 г NaOH.
Определить pH, pOH, [H+], [OH-].
Решение:
Сначала надо определить, сколько г NaOH растворилось бы в 1л (дм3) воды:
В 250 мл раствора содержится 0,2г NaOH
В 1000 мл раствора – x г NaOH. x = 0,8 г/л NaOH.
Следовательно, S΄ – растворимость в г/л – равна 0,8 г/л NaOH.
Далее задача решается по схеме решения задачи на определение ПР.
NaOH ↔ Na++OH-
Только здесь нас будет интересовать лишь концентрация ионов OH-(а в случае с кислотой – концентрация ионов H+):
[OH-]= S *n= S *1
Делаем пересчет:
M(NaOH)=23+16+1=40 г/моль.
1 моль – 40 г
x моль/л – 0,8 г/л
x=1*0,8/40=0,02=2*10-2 моль/л = S
Отсюда [OH-]= S *1 =2*10-2 моль/л*1=2*10-2 моль/л
pOH = -lg[OH-] = -lg2*10-2 = -lg2*10-2 = -lg2 – lg10-2 = -0,3+2 = 1,7
pH+pOH = 14
pH = 14-pOH= 14-1,7 = 12,3 (среда щелочная) т.к. pH>7
[H+]x[OH-]=1*10-14
[H+]=1*10-14/2 *10-2=0,5*10-12=5*10-13 моль/л (моль/дм3)
Пример 4.
Решение:
В 3л раствора содержится 0,009 г H3PO4. Определить: pH, pOH, [H+], [OH-].
H3PO4→3H++PO43-
[H+]=S*n, где S – растворимость в моль/л, n – число ионов в уравнении диссоциации.
[H+]=S*3=…
Определяем растворимость в г/л:
3л – 0,009г кислоты
в 1л - xг кислоты
x=0,003 г/л кислоты.
M(H3PO4)=1*3+31+16*4=98 г/моль
S=0,003/98=0,0000306=3,06*10-5моль/л (моль/дм3)
[H+]=3,06*10-5*3=9,18*10-5моль/л (моль/дм3)
pH = -lg9,18*10-5 = -lg9,18- lg10-5 = -0,9628+5 = 4,0372 < 7, среда раствора кислая
pOH = 14-4,0372 = 9,9628
[OH-]=1*10-14/9,18*10-5=0,108*10-9=1,08*10-10моль/л (моль/дм3)
Пример 5.
В растворе pH=3,58.Определить: [H+], [OH-], pOH.
Решение:
Т.к. pH 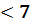 , то среда раствора кислая.
, то среда раствора кислая.
Из формулы: pH = -lg[H+] = 3,58
Определяем [H+] = 10-ph= 10-3.58=10-4*10+0.42=2,63*10-4 моль/л
(10+0.42=2,630 - определяем по таблице Брадиса по антилогарифмам),
pOH = 14-3,58 = 10,42
[OH-]=1*10-14/2,63*10-4 = 0,38*10-10 = 3,8*10-11 моль/л
|
из
5.00
|
Обсуждение в статье: Тема «Ионизация. Водородный и гидроксильный показатели» |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

