 |
Главная |
I. Решение задач на основе данных времен полупревращения
В соответствии с таблицей формальной кинетики время полупревращения для различных порядков позволяет подтвердить выбранный порядок реакции:
n= 0 t 1/2 = Ca0/2k
n= 1 t 1/2 = ln2/k
n= 2 t 1/2 = 1/Ca0 k
n = 3 t 1/2 = 3/2*1/(Ca0)2 k
Как видно из данных в таблице представлены только целочисленные порядки для случая простых реакций. Напоминаем, что n = 0 и 3 не относятся к простым реакциям и рассматриваются вместе для обобщения.
Метод времен полупревращения годится не только для простых реакций, но и сложных реакций, для которых порядок реакции может быть не только целым, но и дробным числом, кратным ½ 3/2 и т.д.
Для решения задач методом времен полупревращения необходимо иметь зависимость t1/2 = f(Ca0 ), т.е. кинетические кривые должны быть получены при различных начальных концентрациях или давлениях:
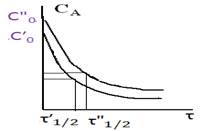
Сравнение математических выражений для различных порядков показывает, что, в общем случае, время полупревращения связано с начальной концентрацией С o следующим соотношением:
t 1/2 = α С o ( 1- n ) , где α = const (1),
Например для n=0 и t 1/2 = Ca0/2k значение α = 1/2k , аналогично для других порядков
Если прологарифмировать соотношение, получим следующее уравнение :
ln t1/2 = ln a + ( 1 - n ) ln Сo (2)
Графический вариант метода времен полупревращения. Из уравнения видно, что логарифм времени полупревращения связан линейно с логарифмом начальной концентрации реагента. Для определения порядка реакции этим методом проводят несколько опытов с различными начальными концентрациями реагента.
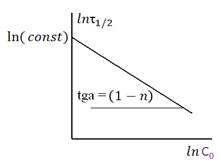
Рис. 1. Определение порядка реакции по концентрационной зависимости времени
полупревращения
Тангенс угла наклона, получающейся прямой равен tg a = 1 – n.
Пример 1. Пользуясь зависимостью между временем полупревращения и начальным давлением, определите порядок для реакции конверсии пара-водорода в орто-водород при температуре 923оК:
| Ро, мм рт,ст, | 50 | 100 | 200 | 400 |
 t1/2, с t1/2, с
| 648 | 450 | 318 | 222 |
Построим график в логарифмических координатах:
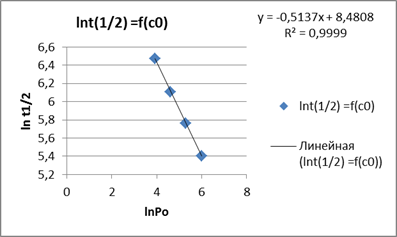
Тангенс угла наклона прямой y = ax +b , где х = lnP0 равен tga = a = 1-n
a = - 0,5137 = 1-n , отсюда n = 1+ 0,5137 » 3/2
При недостатке кинетических кривых можно воспользоваться аналитическим методом времен полупревращения. Отношение двух уравнений (1) с разными начальными концентрациями Со приводит к уравнению для двух  t1/2 :
t1/2 :
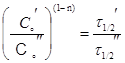 , (3)
, (3)
где индексы C0' и C0'' относятся к двум опытам при различных начальных концентрациях. После логарифмирования получим уравнение для определения порядка:
ln (t’1/2 /(t”1/2 )= (1 - n ) ln (С’o/C0'') и
(1 - n ) = ln (t’1/2 /(t”1/2 )/ ln (С’o/C0'')
Из уравнения 3 можно определить порядок реакции n и затем в случае целочисленных порядков по уравнениям в табл. 1 (колонка 3) определяют константу скорости реакции.
Пример 2. При 300оС время полупревращения реакции разложения вещества А при начальном давлении 400 мм.рт.ст, составляет 300 с, а при исходном давлении 186 мм.рт. ст, t1/2 равно 643 с.
Решение : (1 - n ) = ln (t’1/2 /(t”1/2 )/ ln (С’o/C0'') = ln (300 /(643)/ ln (400/186) = -1
(1 - n ) = -1 и n = 2.
Для n = 2 t 1/2 = 1/Ca0 k ; k = 1/Ca0 t 1/2 = 1/(400*300) = 8,33*10-6 [1/мм.рт.ст*с]

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

