 |
Главная |
Гидролиз по катиону и аниону
|
из
5.00
|
Соли, образованные катионами и анионами, в значительной степени поляризующими молекулы воды, гидролизуются и по катиону и по аниону.
NH4+ + CN- + H2O ↔ NH4OH + HCN
Реакция среды в растворах таких солей близка к нейтральной и определяется сравнительной силой образующихся слабых электролитов. Для данной соли, NH4CN, реакция среды слабощелочная, т.к. при диссоциации гидроксида аммония ( 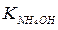 = 1,8·10-5) образуется несколько больше ионов ОН-, чем ионов Н+ при диссоциации синильной кислоты (КHCN = 5·10-10).
= 1,8·10-5) образуется несколько больше ионов ОН-, чем ионов Н+ при диссоциации синильной кислоты (КHCN = 5·10-10).
Раствор нитрита аммония имеет слабокислую среду, т.к. при его гидролизе:
NH4+ + NO2- + H2O Û NH4OН + HNO2
образуются два слабых электролита (NH4OН и HNO2), из которых несколько сильнее диссоциирует азотистая кислота, т.е. количество ионов Н+ в растворе оказывается несколько больше количества ионов ОН- (  ;
;  ).
).
Если хотя бы один из продуктов гидролиза уходит из раствора в виде осадка или газа, то гидролиз становится практически необратимым. Например:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Необратимый гидролиз
Возможность протекания гидролиза необходимо учитывать при сливании растворов солей, содержащих катионы и анионы, способные поляризовать молекулы воды.
Таблица IV.1
Степень гидролиза и рН 0,1 М растворов некоторых солей при 25 оС
| Соль | Слабые электролиты, образующиеся при гидролизе | Степень гидролиза h, % | рН раствора | |
| формула | Константа ионизации | |||
| CH3COONa | CH3COOH | 1,7·10-5 | 0,0076 | 8,88 |
| NH4Cl | NH4OH | 1,76·10-5 | 0,0074 | 5,12 |
| KCN | HCN | 6,2·10-10 | 1,3 | 11,10 |
| NH4CN | HCN и NH4OH | см. выше | 48,8 | 9,23 |
| Na2SO3 | HSO3- | 6,2·10-8 | 0,13 | 10,10 |
| NaHSO3 | H2SO3 | 1,7·10-2 | 0,38 | 4,49 |
| Na2CO3 | HCO3- | 4,8·10-11 | 4,46 | 11,65 |
| NaHCO3 | H2CO3 | 4,5·10-7 | 2,1 | 8,34 |
| (NH4)2CO3 | HCO3- и NH4OH | см. выше | 93,14 | 9,19 |
| CH3COONH4 | CH3COOH и NH4OH | см. выше | 0,57 | 7,00 |
| Na3PO4 | HPO42- | 4,4·10-13 | 37,7 | 12,58 |
| Na2HPO4 | H2PO4- | 6,2·10-8 | 0,53 | 9,79 |
| NaH2PO4 | H3PO4 | 7,6·10-3 | 0,57 | 4,67 |
| Na2S | HS- | 1,3·10-13 | 57,3 | 12,76 |
| NaHS | H2S | 8,9·10-8 | 0,24 | 9,97 |
| (NH4)2S | HS- и NH4OH | см. выше | 99,98 | 9,25 |
| NH4HS | H2S и NH4OH | см. выше | 7,9 | 9,15 |
| NaClO | HClO | 3,9·10-8 | 0,18 | 10,3 |
Рассмотрим, что происходит при сливании растворов хлорида цинка и карбоната натрия. До сливания в каждом из растворов устанавливается определенное равновесие гидролиза:
- по катиону Zn2+ + H2O ↔ ZnOH+ + H+;
- по аниону СО32- + Н2О ↔ НСО3- + ОН-
При сливании растворов идет реакция: Н+ + ОН- = Н2О и равновесие в обеих реакциях смещается вправо, накапливается достаточное количество ионов ZnOH+ для образования осадка основного карбоната цинка (ZnOH)2CO3:
2ZnOH+ + СО32 - ↔ (ZnOH)2CO3↓
Одновременно идет гидролиз по второй ступени ионов НСО3-:
НСО3- + Н2О ↔ Н2СО3 + ОН-
Угольная кислота разлагается: Н2СО3 ↔ Н2О + СО2↑ и гидролиз становится практически необратимым:
2ZnCl2 + 2Na2CO3 + Н2О = (ZnOH)2CO3↓ + СО2↑ + 4NaCl
Подобное наблюдается, если вместо соли цинка взять соли меди (II), кадмия (II), никеля (II).
Несколько иначе идет процесс с солями ртути и свинца; из растворов солей свинца выпадает осадок основного карбоната свинца Pb3(OH)2(CO3)2:
Pb2+ + H2O Û PbOH+ H+
2PbOH+ + Pb2+ + 2CO32- → Pb(PbOH)2(CO3)2↓
Для солей, образованных трехвалентными катионами, реакция по катиону и по аниону протекает до гидроксидов.
Рассмотрим, что происходит при взаимодействии соли хлорида железа (III) с карбонатом натрия. В каждом из растворов устанавливается равновесие:
Fe3+ + H2O Û FeOH2+ + H+;
FeOH2+ + H2O Û Fe(OH)2+ + H+;
CO32- + H2O Û HCO3- + OH-
при сливании растворов идет взаимодействие ионов водорода и гидроксид-ионов: Н+ + ОН- ↔ H2O, равновесия смещаются вправо, и гидролиз взаимно усиливается, при этом становится возможной 3-я ступень гидролиза по катиону:
Fe(OH)2+ + H2O ® Fe(OH)3↓ + Н+
и вторая ступень гидролиза по аниону:
HCO3- + H2O Û H2CO3 + OH-
Как малорастворимое соединение (  = 4·10-38) гидроксид железа выпадает в осадок и образования карбонатных производных железа не происходит. Угольная кислота, как неустойчивое соединение, разлагается с выделением СО2. В результате, при сливании растворов хлорида железа (III) и карбоната натрия, идет следующий процесс:
= 4·10-38) гидроксид железа выпадает в осадок и образования карбонатных производных железа не происходит. Угольная кислота, как неустойчивое соединение, разлагается с выделением СО2. В результате, при сливании растворов хлорида железа (III) и карбоната натрия, идет следующий процесс:
2FeCl3 + 3Na2CO3 + 3H2O = 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
Аналогично взаимодействуют с карбонатами соли Al3+ и Cr3+.
|
из
5.00
|
Обсуждение в статье: Гидролиз по катиону и аниону |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

