 |
Главная |
По произведению растворимости (ПР)
|
из
5.00
|
Величины произведений растворимости для малорастворимых соединений приведены в таблице II (приложение) и справочниках, указанных в списке литературы.
Задача 1. Вычислить растворимость хлорида серебра в моль/л и г/л, если произведение растворимости его равно 1,78·10-10.
Решение. Составляем уравнение, отражающее равновесие в системе осадок Û насыщенный раствор:
AgCl↓ Û Ag+ + Cl- (насыщенный раствор)
Так как произведение растворимости хлорида серебра 1,78·10-10 < 1·10-8, то вычисления можно проводить без учета ионной силы раствора, которая в данном случае очень мала и коэффициенты активности ионов близки к 1 (fi ≈ 1). Запишем общую формулу произведения растворимости AgCl: ПРAgCl = [Ag+][Cl-]
Растворимость данного соединения Р моль/л следовательно, [Ag+] = [Cl-] = Р моль/л и ПРAgCl = Р·Р = Р2, отсюда
РAgCl =  =
=  = 1,33·10-5 (моль/л).
= 1,33·10-5 (моль/л).
М(AgCl) = 108 + 35,5 = 143,5 (г/моль)
Р = 1,33·10-5 · 143,5 = 190,86·10-5 = 1,91·10-3 (г/л).
Задача 2. Вычислите концентрацию ионов свинца (в моль/л) в насыщенном растворе иодида свинца PbJ2, ПР  = 8,7·10-9.
= 8,7·10-9.
Решение. Составим уравнение, отражающее равновесие в системе осадок Û насыщенный раствор:
PbJ2↓ Û Pb2+ + 2J- (нас. раствор)
Расчет будем проводить без учета коэффициента активности по общей формуле: ПР  = [Pb2+] · [J-]2;
= [Pb2+] · [J-]2;
Пусть [Pb2+] = х моль/л, тогда, так как в насыщенном растворе данной соли концентрация ионов иода вдвое больше концентрации ионов свинца, то [J-] = 2[Pb2+] = 2х моль/л. Подставляем х в выражение для ПР  и производим вычисления:
и производим вычисления:
х (2х)2 = 8,7·10-9;
4х3 = 8,7·10-9;
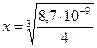 = 1,28·10-3 (моль/л).
= 1,28·10-3 (моль/л).
Следовательно, в 1 литре насыщенного раствора PbJ2 содержится 1,28·10-3 моль ионов Pb2+.
Задача 3. Вычислить растворимость фосфора бария, если ПР  =6,0·10-39.
=6,0·10-39.
Решение. Составим уравнение, отражающее равновесие в системе осадок Û насыщенный раствор:
Ba3(PO4)2↓ Û 3Ba2+ + 2PO43- (нас. раствор)
При диссоциации Р моль/л соли в растворе образуется 3Р моль/л ионов бария и 2Р моль/л ионов PO43-.
Запишем выражение для произведения растворимости данной соли, проведем соответствующие преобразования и выразим Р через ПР:
ПР  = [Ba2+]3· [PO43-]2 ;
= [Ba2+]3· [PO43-]2 ;
ПР  = (3Р)3· (2Р)2 = 27 · 4 · Р5 =108 · Р5 ;
= (3Р)3· (2Р)2 = 27 · 4 · Р5 =108 · Р5 ;
 =
=  = 0,89 ·10-8 = 8,9 · 10-9 (моль/л).
= 0,89 ·10-8 = 8,9 · 10-9 (моль/л).
Примечание. Если в условии задачи растворимость дана в других единицах (г/л или г на 100 мл), обязательно необходимо пересчитать на моль/л.
Для среднерастворимых соединений даже в отсутствии других сильных электролитов при вычислениях необходимо учитывать ионную силу раствора.
Задача 4. Вычислите растворимость хромата кальция CaCrO4 моль/л, если ПР = 7,1·10-4: а) без учета коэффициентов активности; б) с учетом коэффициентов активности.
Решение. CaCrO4 Û Ca2+ + CrO42- (нас. р-р);
а) без учета коэффициентов активности:
 ;
;
[Ca2+] = [CrO42-] = Р моль/л ;
 ;
; 
 (моль/л)
(моль/л)
б) с учетом коэффициентов активности:

Вычисляем ионную силу раствора: 
 По таблице V находим коэффициенты активности для двухзарядных ионов при µ = 0,1: f
По таблице V находим коэффициенты активности для двухзарядных ионов при µ = 0,1: f  = f
= f  = 0,37.
= 0,37.
Растворимость соли равна концентрации ионов Ca2+ или концентрации CrO42- в насыщенном растворе:
[Ca2+] = [CrO42-] = Р моль/л;


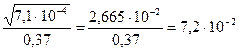 (моль/л).
(моль/л).
|
из
5.00
|
Обсуждение в статье: По произведению растворимости (ПР) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

