 |
Главная |
Малорастворимых электролитов
|
из
5.00
|
Задача 1. В насыщенном растворе сульфата свинца концентрация сульфат-ионов увеличена в 100 раз. Чему станет равна концентрация ионов свинца? Как она изменится и во сколько раз? ПР  = 1,6·10-8.
= 1,6·10-8.
Решение. PbSO4↓ Û Pb2+ + SO42- (нас. р-р)
1. Находим концентрацию ионов [SO42-] в насыщенном растворе сульфата свинца: [SO42-]1 = [Pb2+]1;
ПР  = [Pb2+]1· [SO42-]1;
= [Pb2+]1· [SO42-]1;
ПР  = [SO42-]
= [SO42-] 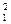 ;
;

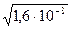 = 1,265·10-4 (моль/л)
= 1,265·10-4 (моль/л)
2. Концентрация ионов SO42- после увеличения в 100 раз стала равна:
[SO42-]II = 1,265·10-4·102 = 1,265·10-2 (моль/л)
3. Вычислим концентрацию ионов Pb2+ из соотношения:
 =
=  = 1,265·10-6 (моль/л)
= 1,265·10-6 (моль/л)
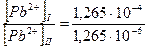 = 100 (раз)
= 100 (раз)
Концентрация ионов свинца уменьшилась в 100 раз, т.е. во столько же раз, во сколько увеличилась концентрация ионов SO  . Можно отвечать на этот вопрос, не производя вычислений. Так как величина ПР – const, то для бинарного электролита увеличение концентрации одного иона в n раз влечет за собой уменьшение концентрации второго иона во столько же раз.
. Можно отвечать на этот вопрос, не производя вычислений. Так как величина ПР – const, то для бинарного электролита увеличение концентрации одного иона в n раз влечет за собой уменьшение концентрации второго иона во столько же раз.
Задача 2. Во сколько раз растворимость оксалата кальция в 0,017 молярном растворе оксалата аммония меньше растворимости его в чистой воде а) без учета коэффициентов активности; б) с учетом коэффициентов активности? ПР  = 2,3·10-9.
= 2,3·10-9.
Решение.
а) без учета коэффициентов активности:
CaC2O4↓ Û Ca2+ + C2O42- (нас. р-р);
ПР  = [Ca2+]·[C2O42-];
= [Ca2+]·[C2O42-];
1. В насыщенном растворе растворимость равна:

 = 4,8·10-5 (моль/л)
= 4,8·10-5 (моль/л)
2. В 0,017 молярном растворе (NH4)2C2O4 [C2O  ] = 0,017 моль/л
] = 0,017 моль/л
Р2 = [Са2+];  1,35·10-7 (моль/л)
1,35·10-7 (моль/л)
3. 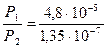 = 3,55·102 = 355 (раз)
= 3,55·102 = 355 (раз)
б) с учетом коэффициентов активности:

Вычислим ионную силу раствора по формуле 
Так как растворимость CaC2O4 мала, ~ 10-5 моль/л, то ионная сила раствора определяется присутствием ионов NH  и C2O
и C2O  , образующихся при диссоциации оксалата аммония:
, образующихся при диссоциации оксалата аммония:
(NH4)2C2O4 = 2NH  + C2O
+ C2O  ,
,
[C2O  ] = 1,7·10-2 моль/л
] = 1,7·10-2 моль/л
[NH  ] = 2·1,7·10-2 = 3,4·10-2 (моль/л)
] = 2·1,7·10-2 = 3,4·10-2 (моль/л)
µ =  (1,7·10-2·22 + 3,4·10-2·12) = 0,051
(1,7·10-2·22 + 3,4·10-2·12) = 0,051
По таблице V находим приближенные значения коэффициентов активности: f  = f
= f  = f = 0,45.
= f = 0,45.
Из выражения для ПР  , т.к. растворимость Р3 = [Са2+], получаем:
, т.к. растворимость Р3 = [Са2+], получаем:

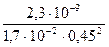 = 6,68·10-7
= 6,68·10-7
 = 72 (раза)
= 72 (раза)
Солевой эффект
Задача 1. Вычислить растворимость сульфата бария в воде, в 0,01 молярном растворе хлорида натрия. ПР  = 1,1·10-10.
= 1,1·10-10.
Решение. BaSO4↓ Û Ba2+ + SO  (нас. р-р)
(нас. р-р)
1. Вычисляем растворимость в воде, пользуясь упрощенным выражением произведения растворимости, т.к. электролит бинарный и ПР < 10-8.
ПР  = [Ba2+]·[SO
= [Ba2+]·[SO  ]; в насыщенном растворе над осадком:
]; в насыщенном растворе над осадком:
[Ba2+] = [SO  ] = Р1 моль/л;
] = Р1 моль/л;
ПР  = P
= P  ;
;

 = 1,05·10-5 (моль/л)
= 1,05·10-5 (моль/л)
2. Для вычисления растворимости Р2 в присутствии 0,01 молярного раствора NaCl воспользуемся следующим алгоритмом:
а) вычислить ионную силу раствора;
б) по таблице найти коэффициенты активности ионов, входящих в состав осадка;
в) вычислить растворимость с учетом коэффициентов активности.
а) Ионная сила раствора обусловлена присутствием ионов Na+ и Cl-, т.к. концентрация ионов Ba2+ и SO  очень мала ~ 10-5 моль/л.
очень мала ~ 10-5 моль/л.
 ; µ = 1/2(0,01· 12 + 0,01·12) = 0,01;
; µ = 1/2(0,01· 12 + 0,01·12) = 0,01;
б) для двухзарядных ионов Ba2+ и SO  коэффициенты активности (табл. V) равны f
коэффициенты активности (табл. V) равны f  = f
= f  = f = 0,67;
= f = 0,67;
в) запишем произведение растворимости:

учитывая, что  моль/л, получим:
моль/л, получим:
ПР  = Р
= Р  · f2; отсюда выразим растворимость:
· f2; отсюда выразим растворимость:
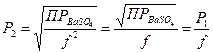 =
= 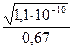 =
=  = 1,57·10-5 (моль/л)
= 1,57·10-5 (моль/л)
Сравнивая Р2 и Р1, получим:
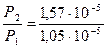 = 1,5 (раза)
= 1,5 (раза)
Вывод: в присутствии 0,01 молярного раствора хлорида натрия растворимость сульфата бария увеличилась в 1,5 раза.
Вопросы и задачи для самостоятельного решения
1. Сформулируйте правило произведения растворимости.
2. Приведите примеры использования реакций осаждения в анализе.
3. Напишите выражение ПР для: а) сульфата бария; б) хлорида свинца (II); в) фосфата алюминия; г) гидроксида железа (III); д) фосфата кальция; е) сульфида серебра.
4. Запишите неравенство, характеризующее: а) ненасыщенный раствор; б) пересыщенный раствор.
5. Запишите равенство, характеризующее насыщенный раствор.
6. Перечислите, от каких факторов зависит растворимость осадков.
7. Что такое солевой эффект?
8. Какое влияние оказывает присутствие избытка осадителя на растворимость осадка?
9. Какая соль более растворима и во сколько раз?
а) Сульфат бария, сульфат кальция.
б) Хлорид серебра, бромид серебра.
в) Оксалат кальция, оксалат бария.
г) Иодид свинца, сульфид серебра.
д) Фторид кальция, хлорид свинца.
е) Бромид серебра, фторид кальция.
10. Вычислите растворимость гидроксила цинка в г/л и моль/л, если при 18 оС ПР 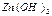 = 7,1·10-18.
= 7,1·10-18.
Ответ: 1,19·10-4 г/л, 1,2·10-6 моль/л.
11. Найдите растворимость следующих соединений в моль/л и г/л: сульфат кальция; карбонат бария; фторид кальция; иодид свинца; фосфат бария; гидроксид меди; гидроксид железа (III); сульфид серебра; сульфид свинца; хромат бария; хлорид свинца (II).
12. В 1 л насыщенного раствора карбоната кальция содержится 6,9·10-3 г CaCO3. Вычислите произведение растворимости карбоната кальция в этих условиях.
Ответ: ПР = 4,8·10-9.
13. Вычислите, будет ли образовываться осадок сульфата кальция при сливании равных объемов 0,002 моль/л растворов сульфата натрия и хлорида кальция. ПР  = 2,5·10-5.
= 2,5·10-5.
Ответ: не будет.
14. Вычислите, выпадет ли осадок хлорида серебра при смешивании 30 мл 0,01 моль/л раствора хлорида натрия и 10 мл 0,001 моль/л раствора нитрата серебра. ПРAgCl = 1,78·10-10.
Ответ: выпадет.
15. Объясните механизм растворения AgCl в NH4OH и Mg(OH)2 в NH4Cl с точки зрения правила произведения растворимости.
16. На раствор, содержащий 1 моль ионов Ba2+ и 0,01 моль ионов Ca2+, действуют раствором (NH4)2C2O4. Какой катион будет осаждаться первым и почему?
Ответ: ион бария.
17. Сколько потребуется воды для растворения 2 г карбоната бария при температуре 20оС, если ПР  = 8,1·10-9?
= 8,1·10-9?
Ответ: 112,8 л.
18. Насыщенный раствор сульфата кальция слили с равным объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в 1л. Произойдет ли образование осадка оксалата кальция – СаС2О4? ПР  = 3,8·10-9, ПР
= 3,8·10-9, ПР  = 2,4·10-5?
= 2,4·10-5?
Ответ: 1,5·10-7, образуется.
19. Какие анионы следует использовать для более полного осаждения ионов бария, если ПР  = 8,0·10-9; ПР
= 8,0·10-9; ПР 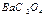 = 1,6·10-7; ПР
= 1,6·10-7; ПР  = 1,1·10-10; ПР
= 1,1·10-10; ПР 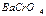 = 2,4·10-10?
= 2,4·10-10?
Ответ: SO 
20. Вычислите, во сколько раз растворимость сульфата бария (в моль/л) в чистой воде превышает растворимость этой соли в 0,05 моль/л растворе сульфата калия. ПР 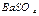 = 1,1·10-10
= 1,1·10-10
Ответ: в 5000 раз.
21. Вычислите, во сколько раз растворимость иодида свинца (II) в чистой воде меньше растворимости его в 0,034 моль/л растворе нитрата магния. ПР  = 1,1·10-9.
= 1,1·10-9.
Ответ: в 1,7 раза.
|
из
5.00
|
Обсуждение в статье: Малорастворимых электролитов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

