 |
Главная |
Методические рекомендации. При изучении этой темы основное внимание рекомендуется обратить на следующие
|
из
5.00
|
При изучении этой темы основное внимание рекомендуется обратить на следующие вопросы: основные положения теории Вернера, номенклатуру, свойства, способы получения комплексных соединений, значения.
1 Определение комплексных соединений
Такие соединения, как оксиды, кислоты, основания, соли, образованы из атомов в результате возникновения между ними химической связи. Это соеди нения обычные или соединения первого порядка. Однако имеются вещества, которые образованы в результате соединения друг с другом нейтральных молекул без возникновения новых связующих электронных пар. Например:
K2 SO4 +AL2 (SO 4 )3  2 K AL (SO4 )2
2 K AL (SO4 )2
Cu SO4 + 5H2 O  Cu SO4 * 5H2 O
Cu SO4 * 5H2 O
Cu SO4 + 4 NH3  Cu SO4 * 4NH3 =
Cu SO4 * 4NH3 =  Cu
Cu  NH3
NH3  4
4 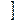
 SO4
SO4
Fe  CN
CN  3 + 3 KCN = Fe
3 + 3 KCN = Fe  CN
CN  3 * 3 KCN = K3
3 * 3 KCN = K3  Fe
Fe  CN
CN  6
6 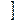
2 KJ + Hg J2 = 2 KJ* Hg J2 = K2  Hg J4
Hg J4 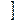
Это молекулярные соединения или соединение высшего порядка. Один из них диссоциирует в водном растворе на простые ионы. Например:
K AL  SO4
SO4  2
2  K+ + AL3+ + 2 SO4 2-
K+ + AL3+ + 2 SO4 2-
другие на сложные ионы ( комплексные), состоящие в свою очередь из более
простых ионов, как, например:
K3  Fe
Fe  CN
CN  6
6 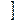
 3 K+ +
3 K+ +  Fe
Fe  CN
CN  6
6  3-
3-
Молекулярные соединения, образующие комплексные ионы, способные к существованию как в растворе, так и в кристалле, называются
комплексными. Чтобы объяснить, почему происходит присоединение одних простых молекул к другим швейцарский химик А. Вернер ввёл понятие о главной и побочной валентности. Образование молекулы K2 [Hg J4] можно представить так: ион ртути засчёт своей главной валентности (обозначается сплошной линией), равным двум, присоединяет два иодид - иона, а за счёт побочной (обозначается пунктиром) дополнительно ещё два иодид – иона. По Вернеру это изображается формулой:







 K+ J J
K+ J J
Hg

 K+
K+
 J J
J J


 Главная валентность образована ионной и ковалентной связью, а побочная
Главная валентность образована ионной и ковалентной связью, а побочная
ковалентной связью, возникает по донорно – акцепторному механизму.
Таким образом: комплексные соединения –это соединения, характеризу-
ющиесяналичиемхотя бы одной ковалентной связи, возникшей по
донорно – акцепторному механизму.
2Основные понятия координационной теории
В химии комплексных соединений большая роль принадлежит координационной теории, созданной А. Вернером. Она наиболее удачно объясняет их свойства и строение. Суть теории сводится к следующему:
1) центральное место в комплексном соединении занимает комплексообра- зователь – обычно положительно заряженный ион (чаще металл);
2) вокруг комплексообразователя расположены или координированные лиганды т.е ионы противоположного знака или нейтральные молекулы;
3) комплексообразователь и лиганды внутреннюю сферу комплексного соединения;
4) ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексного соединения. Например:
 |  |  | |||
CN-
К+ CN- CN-
K+ Fe 3+
CN-
CN- CN-
K+
 | |||
 |
5) число, показывающее сколько лигандов удерживает комплексообразователь называют координационным числом
Для написания формулы комплексного соединения надо знать:
1) заряд (степень окисления) комплексообразователя;
2) заряд лигандов;
3) координационное число;
4) ионы внешней сферы.
Типичными комплексообразователями являются d- элементы периодической системы Д.И. Менделеева. Это Ag+, Au+3, Cu +, Cu +2 , Hg 2+, Cd2+ , Zn2+, Fe2+ , Fe 3+, Co3+, Ni2+, Pt4+ и другие. Однако и катионы других элементов в определённых условиях способны к комплексообра - зованию: AL3+, Ca2+, Ba2+, Sr 2+, Mg2+.
Важнейшими лигандами являются:
а) нейтральные молекулы, имеющие дипольный характер: H2O, CO, NO, NH3 и др.
б) ионы: CN-, CL-, Br - , J -, NO2-, OH-, C2 O 42- и др.
Каждый из лиганд : CN- , Br - , J-, OH,- H2 O, NH3, CO, NO - занимают только одно координационное число у центрального атома- комплексообра- зователя. Такие лиганды называют монодентатными. Число монодентат- ных лиганд в координационной сфере равно координационному числу. Например:  Fe3+ (CN-)6
Fe3+ (CN-)6  3- CN - - монодентатная лиганда, число CN- т.е количество лиганд равно 6 - коордиацинному числу комплексообразователя Fe3+ - иона.
3- CN - - монодентатная лиганда, число CN- т.е количество лиганд равно 6 - коордиацинному числу комплексообразователя Fe3+ - иона.
Многие лиганды содержат два или более атомов, способных участвовать в координации. Такие атомы часто называютдонорными. Например: С2 О42- - имеет два донорных атома О, а анион – дидентатный, этилендиаминтетраацитат имеет два донорных атома N и четыре донорных атома О, является гексадентатным лигандом
Дентатностькоординационная ёмкость лиганда– это число координационных мест, которое может занимать данный лиганд. Дентатность лиганда определяется числом донорных атомов, входящих в его состав. Лиганда, содержащие два или более донорных атомов, называется полидентатными лигандами.
:ООС – СОО: - оаксалато – дентатность = 2
NH2 - CH2 - CH2- NH – СH2 – CH2 – NH2 - диэтилен триамин дентатность = 2
NH2 - CH2- CH2- NH2 - этилендиамин дентатность =3

 : ООССН2 CH2 COO:
: ООССН2 CH2 COO:
 N - CH2 –CH2 – N
N - CH2 –CH2 – N
 : ООСН2 С ЭДТА, дентатность = 6
: ООСН2 С ЭДТА, дентатность = 6
CH2 COO:
Чтобы написать формулу комплексного соединения надо знать координационное число иона комплексообразователя:
| Ag+ Au+ Cu+ | Cu2+ Hg2+ Au3+ Cd2+ Pt2+ | Fe2+ Fe3+ Co2+ Ni2+ Cr3 + Al3+ Zn2+ Pt 4+ Pb4+ | Ca2+ Sr2+ Ba2+ |
Ионами внешней среды часто являются ионы щелочных и щелочноземель ных металлов, аммоний и др. Некоторые комплексные соединения не имеют внешней сферы. Это  Pt
Pt  NH3
NH3  2 CL 4
2 CL 4  ;
;  Со3+ (NH3)3 СL 3].
Со3+ (NH3)3 СL 3].
У них отрицательный заряд ионов, входящий во внутреннюю сферу, равен положительному заряду комплексообразователя.
3Номенклатура комплексных соединений
В соответствии с правилами Международного союза по теоретической и прикладной химии (ИЮПАК) наименования комплексных соединений образуются следующим образом. Независимо от заряда координационной сферы сначала называют анион, а затем катион.
В названии координационной сферы перечисляют все её составные части справа налево, при этом сначала называют число лигандов, затем сами лиганды и, наконец комплексообразователь с указанием степени окисления. Для обозначения числа лигандов используют греческие числительные 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта, если координационная сфера заряжена положительно, то комплексообразователь называют по - русски в Р.п.  AL
AL  OH2
OH2  6
6 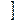 CL3 – гексаакво- алюминия (3) хлорид
CL3 – гексаакво- алюминия (3) хлорид
Если координационная сфера заряжена отрицательно, то комплексообразо- ватель называют по- латыни с окончанием - ат, степень окисления указывают в скобках римскими цифрами. K4  Fe
Fe  CN
CN  6
6 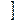 - калия гексацианоферрат (3).
- калия гексацианоферрат (3).
Если координационная сфера имеет нулевой заряд, то комплексообразова- тель называют по– русски, но в И.п.  Fe
Fe  CO5
CO5 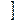 - железа пентакарбонил.
- железа пентакарбонил.
4Химическая связь комплексных соединений
Комплексные соединения очень многочисленны и разнообразны по строению своих координационных сфер, а значит, и по своим химическим и физическим свойствам. В настоящее время для объяснения образования и свойств комплексных соединений существуют теории кристаллического поля и метода валентных связей. Согласно методу валентных связей координационные связи между комплексообразователем и лигандом образуются по донорно-акцепторному механизму, а геометрическая форма координационной сферы определяется типом гибридизации электронных орбиталей комплексообразователя. Теория валентных связей не объясняет существования искажённых октаэдрических сфер. Также МВС не объясняет свойства комплексных соединений, как цветность, спектр поглощения.
С точки зрения метода валентных связей координационные связи имеют ковалентную природу.
Теория кристаллического поля исходит из противоположного предложе- ния и чисто ионной природы связи между комплексообразователем и
лигандом, то есть связь осуществляется за счёт электростатического взаимодействия лигандов с электронами d- элементов
комплексообразователя.





 NH3
NH3  NH3 3-
NH3 3-
 + - Ag+ - + -
+ - Ag+ - + -  Cl- K+ CN- CN-
Cl- K+ CN- CN-
CN- Fe3+ K+

 K + CN- CN-
K + CN- CN-
Однако эта теория становится бесполезной, если связь в комплексных
соединениях приближена к ковалентной. Таким образом, теория кристал-
лического поля применима для ионных комплексов. Более полно даёт
объяснение теория молекулярных орбиталей, которую в теории комплексных
соединений называют теорией поля лигандов. Из трёх теорий метод молеку-
лярных орбиталей является перспективной, но очень сложной, не даёт
наглядного представления.
5 Изомераминазывают такие соединения, которые имеют один и тот же
количественный и качественный состав и одинаковую массу, но разное
структурное строение и обладают различными свойствами.
Существует несколько типов изомерии:
1) Геометрическая или пространственная- различное расположение лигандов по отношению к плоскости комплексообразователя. Например:

 Cl NH3
Cl NH3



 Cl NH3
Cl NH3


 Cl Pt NH3
Cl Pt NH3






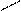 Cl Cl Cl Pt Cl
Cl Cl Cl Pt Cl



NH3 Cl
цис- изомер транс- изомер
 -
-
два изомера различаются растворимостью, оттенком цвета и другими
свойствами. Изомерия вызвана неодинаковым расположением NH  в пространстве. Существуют также оптические изомеры или антиподы, они отличаются способностью вращать плоскость поляризации света в разных направлениях. Теория Вернера предсказала возможность оптической изомерии у некоторых комплексных соединений.
в пространстве. Существуют также оптические изомеры или антиподы, они отличаются способностью вращать плоскость поляризации света в разных направлениях. Теория Вернера предсказала возможность оптической изомерии у некоторых комплексных соединений.
например, 
En O Cl O En En- этилендиамин





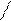
 Co Cl
Co Cl

En O Cl Co

Cl O En
d-изомер L -изомер
антиподы
Гидратная изомерия обусловлена неодинаковым расположением воды между внутренней и внешней сферами комплексного соединения


Хлорид гексааквахрома хлорид тетрааквадихлора-хрома (III) (темно-зеленый)
(III) (фиолетовая)
При взаимодействии с AgNO  , у первого выпадает весь хлорид- ион остается осадок, у второго 1/3 Cl
, у первого выпадает весь хлорид- ион остается осадок, у второго 1/3 Cl  .
.
Ионизационная изомерия-неодинаковое расположение кислотных остатков между внутренней и внешней сферами


Сульфат-пента-аммино бромид-пента-аммино-
бромидокобальта (III)) сульфокобальта (III))
(красно-фиолетовый)  (красный)
(красный)
1)комплексное соединение взаимодействует с BaCl 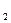 ,осаждает SO
,осаждает SO  ион;
ион;
2) во втором случае-AgNO 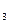 осаждает бромид-ион.
осаждает бромид-ион.
6Устойчивость комплексных соединений
При растворении кристаллического комплексного соединения в воде его кристаллическая решётка разрушается, то есть комплексные соединения диссоциируют на ионы внешней и внутренней сферы
K 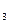 ( Fe ( CN)6 )
( Fe ( CN)6 ) 
 3K+ + [ Fe ( CN- )6]3-
3K+ + [ Fe ( CN- )6]3-
Комплексные ионы в свою очередь подвергаются вторичной диссоциации:
[ Ag ( CN)2 ]-  Ag+ + 2 CN-
Ag+ + 2 CN-

Однако эта диссоциация обычно протекает в незначительной степени. Применяя закон действующих масс к обратимым процессам, получим выражение константы нестойкости комплексных ионов
 К н (Ag ( CN)2 )- =
К н (Ag ( CN)2 )- =  ( Ag+) * (CN-) 2 = 1, 0 * 10-21
( Ag+) * (CN-) 2 = 1, 0 * 10-21
( (Ag ( CN)2 )-)
К н ( Fe (CN)6)3- = ( Fe3+) * ( CN-)6 = 1,0 * 10-44
( ( Fe (CN)6)3-)
Константа нестойкости комплексного иона характеризует прочность (устойчивости) внутренней сферы комплексного соединения. В приведённых примерах ( Fe ( CN)6)3- более прочен, чем комплекс ( Ag (CN)2)-
Соединения с малоустойчивой внутренней сферой называют двойными солями
K2 SO4 * Al2 (SO4 )3; ( NH4)2 SO4 * Fe SO4 * 6 H2O - соль
(NH4)2 SO4 * Fe SO4* 6H2O 2NH4++ Fe2+ + 2SO42-+ 6H2O
все образовавшиеся в растворе при диссоциации ионы можно обнаружить с помощью соответствующих реакций.
Так как диссоциация комплексного иона является процессом обратимым, то выводя из сферы реакции посылаемые им ионы, можно практически разрушить комплекс.
Например (Ag (NH3) Cl  ( Ag (NH3)2 )+ + Cl-
( Ag (NH3)2 )+ + Cl-
(Ag ( NH3)2 )+  Ag+ + 2NH3
Ag+ + 2NH3
(Ag (NH3)2 ) Cl + 2HNO3 = Ag Cl + 2 NH4 NO3
(Ag (NH3)2 ) + + Cl + 2H+ → Ag Cl + 2 NH4+
Разрушение комплекса может произойти и в результате образование какого – либо более прочного комплекса, т.е обладающей меньшей Кн. Например:
[Ag ( NH3)2 ]Cl + 2KCN = K [ Ag ( CN)2 ] + K Cl +2 NH3
 [ Ag ( NH3)2 ]+ + 2 CN- = [Ag ( CN)2 ]- + 2 NH3
[ Ag ( NH3)2 ]+ + 2 CN- = [Ag ( CN)2 ]- + 2 NH3
|
из
5.00
|
Обсуждение в статье: Методические рекомендации. При изучении этой темы основное внимание рекомендуется обратить на следующие |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

