 |
Главная |
Расход воздуха при горении
|
из
5.00
|
Минимальное количество воздуха, необходимое для полного сгорания единицы массы (кг) или объема (м3)горючего вещества, называется теоретически необходимым и обозначается  .
.
Таблица 1.2 - Теоретически необходимое количество воздуха для полного сгорания веществ
| Горючее вещество | Количество воздуха для сгорания 1 кг вещества при 101,3 кПа | Горючее вещество | Количество воздуха для сгорания 1 кг вещества при 101,3 кПа | ||
| кг | м3 | кг | м3 | ||
| Ацетон | 9,45 | 7,35 | Ацетилен | 15,4 | 11,9 |
| Бензол | 13,2 | 10,25 | Бутан | 39,8 | 30,94 |
| Бензин | 14,3 | 11,1 | Водород | 3,08 | 2,38 |
| Древесина | 5,4 | 4,18 | Водяной газ | 2,84 | 2,2 |
| Керосин | 14,85 | 11,5 | Метан | 12,3 | 9,52 |
| Нефть | 13,9 | 10,8 | Окись углерода | 3,08 | 2,38 |
| Толуол | 12,9 | 10,0 | Пропан | 30,6 | 23,8 |
| Торф (воз-душно-сухой) | 7,5 | 5,8 | Природ-ный газ | 6,45 | 5,0 |
Примечание - Объем воздуха приведен к нормальным условиям.
В таблице 1.2 приведены значения теоретически необходимых количеств воздуха для полного сгорания различных веществ при 0 °С и 101,3 кПа. Значения величин, приведенных для древесины, торфа, бензина, керосина, нефти и водяного газа, являются средними, так как состав этих горючих материалов непостоянен.
Вид формулы для расчета теоретически необходимого количества воздуха зависит от состава горючего вещества. Горючее вещество - индивидуальное химическое соединение. Для таких горючих веществ, вне зависимости от их агрегатного состояния, теоретически необходимое количество воздуха определяется из уравнений реакции горения. На m кмольгорючего вещества приходится m кмоль кислорода и 3,76 mкмоль азота. Обозначив массу (в кг) горючего вещества, численно равную его молекулярному весу, через М, составляют пропорцию:
m×М (кг) - (n +3,76 n)×22,4 (м3)
1 (кг) -  (м3),
(м3),
где 22,4 м3 - объем 1 кмоль газов при 0 °С и 101,3 кПа.
Теоретически необходимое количество воздуха для сгорания 1 кг вещества равно (из пропорции):
 , (1.2)
, (1.2)
Подобным образом выводится уравнение для определения теоретически необходимого количества воздуха для сгорания 1 м3 горючих газов:
 , (1.3)
, (1.3)
Если объемы воздуха, полученные по формулам (1.2) и (1.3), необходимо привести к иным условиям температуры и давления, то пользуются формулой:
 , (1.4)
, (1.4)
где  - заданная температура газов, К;
- заданная температура газов, К;
 - заданное давление, Па.
- заданное давление, Па.
Такие вещества, как древесина, торф, каменный уголь, нефть, являясь горючими веществами, представляют собой сложную смесь химических соединений. При определении теоретически необходимого для их сгорания объема воздуха нужно знать элементарный состав горючего вещества, выраженный в весовых процентах, т. е. содержание углерода, водорода, кислорода, серы, азота, золы и влаги. Элементарный состав вещества определяют в аналитических лабораториях.
Для вывода уравнения расчета  запишем уравнение реакции горения углерода, водорода и серы и весовое соотношение реагирующих веществ:
запишем уравнение реакции горения углерода, водорода и серы и весовое соотношение реагирующих веществ:
С + О2 = СО2; 2Н2 + О2 = 2Н2О; S + О2 = SO2 ;
12 + 32 = 44; 4 + 32 = 36; 32 + 32 = 64;
Если для сгорания 12 кг углерода требуется 32 кгкислорода, то для 0,01 кг углерода (1 весовой процент) потребуется кислорода 0,01·32/12 = 0,01·8/3 (кг), для водорода соответственно потребуется 0,01·32/4 = 0,01·8 (кг) кислородаи для серы 0,01·32/32 = 0,01·1 (кг) кислорода.
Для полного сгорания 1 кг горючего вещества потребуется кислорода (в кг):
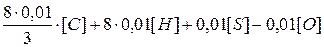 ,
,
где [С], [Н], [S] и [О] — содержание углерода, водорода, серы и кислорода в горючем веществе; весовой процент.
На вычисленное количество кислорода в воздухе приходится в 77/23 раза больше азота. Сумма азота и кислорода составляет количество воздуха (в кг). Количество воздуха  , необходимое для горения 1 кг вещества:
, необходимое для горения 1 кг вещества:
 .
.
Проведя преобразования, получим:
 . (1.5)
. (1.5)
Чтобы выразить количество воздуха в объемных единицах, нужно выражение (1.6) разделить на массу 1 м3 воздуха при 0 °С и давлении 101,3 кПа, т. е. 1,293 кг/м3. В результате получим:
 .
.
Рассмотрим горючее вещество, как смесь газов. К этой группе веществ относятся горючие газы, например, природный, доменный, коксовый и др. Все они в том или ином количестве содержат СО, СН4, H2, H2S, C2Н4 и другие компоненты. Состав горючих газов обычно выражают в объемных процентах.
Для вывода формулы расчета  напишем уравнение реакции горения наиболее распространенных газов:
напишем уравнение реакции горения наиболее распространенных газов:
СН4 + 2О2 = СО2 + 2Н2О H2S + 1,5О2 = Н2О + SO2
2СО + О2 = 2СО2; 2Н2 + О2 = 2Н2О
Если на сгорание 1 м3 метана требуется 2 м3 кислорода, как это видно из уравнения, то на сгорание 0,01 м3 метана, т. е. 1 объемный процент, потребуется 0,01·2 м3 кислорода. Для окиси углерода на это же количество потребуется 0,01/2 м3, для водорода 0,01/2 м3, а для сероводорода 0,01/1,5 м3.
Для полного сгорания 1 м3 горючего газа потребуется кислорода (в м3):
 ,
,
где [СН4], [Н2], [СО], [H2S] и [О2] — содержание метана, водорода, окиси углерода, сероводорода и кислорода, объемный процент.
В воздухе на этот объем кислорода приходится в 79/21 раза больше азота. Сумма азота и кислорода составляет объем (м3) воздуха, необходимый для сгорания 1 м3 газа:

Сделав преобразования, получим:
 .
.
Практически при горении во время пожара расходуется воздуха значительно больше теоретически необходимого. Разность между количеством воздуха, практически расходуемым на горение и теоретически необходимым, называется избытком воздуха. Отношение же количества воздуха, практически расходуемого на горение (  ), к теоретически необходимому называется коэффициентом избытка воздуха и обозначается
), к теоретически необходимому называется коэффициентом избытка воздуха и обозначается 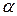 :
:
 . (1.6)
. (1.6)
Для ориентировочных расчетов необходимое количество воздуха для сгорания 1 кг горючего вещества можно рассчитать по формуле:
 (м3), (1.7)
(м3), (1.7)
где 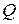 - тепловая способность горючего вещества, кДж/кг.
- тепловая способность горючего вещества, кДж/кг.
Тепловая способность горючего вещества 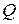 вычисляют по формуле:
вычисляют по формуле:
 , (1.8)
, (1.8)
где  - теплота сгорания, кДж;
- теплота сгорания, кДж;
 - молекулярная масса горючего, кг.
- молекулярная масса горючего, кг.
Расчетами установлено, что для сгорания древесины необходимо 5,04 м3 воздуха, а для нефтепродукта – 11, 6 м3 .
В условиях пожара, когда горение протекает с естественным притоком воздуха, коэффициент избытка воздуха в большинстве случаев больше единицы и колеблется в широких пределах.
Температура горения
Выделяющееся в зоне горения тепло воспринимается продуктами сгорания, вследствие чего они нагреваются до высокой температуры. Та температура, до которой в процессе горения нагреваются продукты сгорания, называется температурой горения. Различают калориметрическую, теоретическую и действительную температуры горения. Действительная температура горения для условий пожара называется температурой пожара.
Под калориметрической температурой горения понимают ту температуру, до которой нагреваются продукты полного сгорания при следующих условиях:
1) все выделяющееся при горении тепло расходуется на нагревание продуктов сгорания (потери тепла равны нулю);
2) начальная температура воздуха и горючего вещества равна 0 °С;
3) количество воздуха равно теоретически необходимому ( 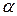 = 1);
= 1);
4) происходит полное сгорание.
Калориметрическая температура горения зависит только от состава горючего вещества и не зависит от его количества.
Теоретическая температура, в отличие от калориметрической, характеризует горение с учетом эндотермического процесса диссоциации продуктов сгорания при высокой температуре:
2СОз → 2СО + О2 — 570,2 кДж
2Н2О → 2Н2 + О2 — 478,2 кДж
Практически диссоциацию продуктов сгорания необходимо учитывать только при температурах выше 1700 °С. При диффузионном горении веществ в условиях пожара действительные температуры горения не достигают таких значений, поэтому для оценки условий пожара используют только калориметрическую температуру горения и температуру пожара. Различают температуру внутреннего и наружного пожара.
Температура внутреннего пожара - это средняя температура дыма в помещении, где происходит пожар. Температура наружного пожара - температура пламени.
В действительности не вся теплота, выделяющаяся при горении в условиях пожара, расходуется на нагревание продуктов сгорания. Большая часть ее расходуется на нагревание конструкций, подготовку горючих веществ к горению, нагревание избыточного воздуха и др. В связи с этим температура внутреннего пожара значительно ниже калориметрической. Так, через 10 мин после
развития внутреннего пожара температура пожара составляет примерно от 0,1 до 0,2 части калориметрической температуры, через 20 мин от 0,2 до 0,3, через 30 мин от 0,3 до 0,35, через 40 мин от 0,35 до 0,4. Пользуясь этими данными, можно по калориметрической температуре находить температуру внутреннего пожара.

Рисунок 1.2 - Температурный режим пожара при горении различных веществ
На рисунке 1.2 показано изменение температуры внутреннего пожара (температурный режим пожара) при горении различных твердых материалов. Как показывает ход кривых, температура пожара при горении всех веществ первоначально растет, достигая максимума, а затем по мере выгорания материала постепенно понижается.
Диффузионное пламя
Пространство, где сгорают пары и газы, называется пламенем или факелом. Пламя может быть кинетическим или диффузионным в зависимости от того, горит ли заранее подготовленная смесь паров или газов с воздухом или такая смесь образуется непосредственно в пламени в процессе горения. В условиях пожара газы, жидкости и твердые вещества горят диффузионным пламенем.
Структура диффузионного пламени существенно зависит от сечения потока горючих паров и газов и его скорости. По характеру потока различают ламинарное и турбулентное диффузионное пламя. Ламинарное пламя возникает при малых сечениях потока паров или газов, движущихся с небольшой скоростью (пламя свечи, спички, газа в горелке небольшого диаметра и т. д.). На пожарах при горении всех веществ образуется турбулентное пламя. Оно меньше изучено, и для объяснения этого явления используют положения теории ламинарного пламени. На рисунке 1.3 показано строение ламинарного диффузионного пламени на примере пламени жидкости, горящей в сосуде небольшого диаметра. Пламя состоит из зоны горения и зоны паров, последняя занимает почти весь объем пламени.

| Зона \горения |
| Воздух |
| Воздух |
Рисунок 1.3 - Строение ламинарного диффузионного пламени
Подобное по строению пламя образуется также при горении газов и твердых веществ, если скорость движения газов и паров находится в ламинарном режиме. Зона горения в диффузионном пламени представляет очень тонкий слой, в котором протекает реакция горения. Превращение веществ и выделение тепла в этом слое вызывает возникновение молекулярной диффузии в прилегающих к нему слоях воздуха и горючего. Причиной молекулярной диффузии является разность парциальных давлений и температур газов, участвующих в горении.
| Сажа |

 |
Рисунок 1.4 - Температура зон пламени при горении керосина
Температура в зоне паров значительно ниже, чем в зоне горения. Так, в пламени керосина (рисунок 1.4) температура потока паров около поверхности жидкости равна температуре ее кипения. По мере движения потока к зоне горения температура паров (на рисунке 1.4 - точки на вертикальной линии) повышается сначала за счет излучения зоны горения, а затем диффузии из нее нагретых продуктов сгорания. В результате нагрева происходит термическая диссоциация паров около зоны горения и образуются свободные атомы и радикалы совместно с продуктами горения.
Атомы углерода, поступая в зону горения, возбуждаются и, будучи некоторое время в свободном состоянии, светятся. Если вместо углерода вводить в пламя частицы других твердых веществ, пламя приобретает иной, чем при горении углерода, цвет. Так, если в несветящее пламя метилового спирта ввести соль стронция, то пламя окрасится в красный цвет, при введении соли меди - в синий или зеленый.
Температура зоны горения пламени меняется по его высоте. Объясняется это изменением состава стехиометрической смеси в зоне горения и затратой тепла на нагрев поступающего в нее воздуха. В нижней части пламени, хотя и образуется стехиометрическая смесь с наибольшей теплотой горения, однако, температура горения не является здесь максимальной, так как значительное количество тепла затрачивается на нагрев холодного воздуха. В средней части пламени теплота горения стехиометрической смеси меньше, чем в нижней, за счет диффузии в нее продуктов сгорания, однако, поступающий в зону горения нагретый воздух компенсирует потери тепла, и температура горения в этой части пламени является максимальной. В верхней части диффузионного пламени стехиометрическая смесь имеет еще меньшую теплоту горения, и нагретый воздух, поступающий для ее образования, не может компенсировать всех потерь тепла, поэтому температура горения здесь минимальная. В связи с этим в верхней части пламени часто образуется сажа.
Турбулентное пламя отличается от ламинарного тем, что не имеет четких очертаний и постоянного положения фронта пламени. Температура его при горении нефтепродуктов составляет: бензина 1200 °С, керосина 1100 °С, нефти 1100 °С, мазута 1000 °С. При горении древесины в штабелях температура турбулентного пламени достигает от 1200 до 1300 °С.
Горение может осуществляться в двух режимах:
- самовоспламенения, заключающемся в самопроизвольном возникновении пламенного горения предварительно нагретой до некоторой критической температуры горючей смеси (называемой температурой самовоспламенения) и проявляющегося в одновременном (в виде вспышки) сгорании всей горючей смеси;
- режиме распространения волны горения (распространения фронта пламени) по холодной смеси при ее локальном зажигании (воспламенении) внешним источником.
Для получения представлений о распространении волны горения поместим гомогенную горючую смесь в стеклянную трубку, открытую с одного конца, и воспламеним ее внешним источником у открытого конца.
Распространяющееся вначале сферически, пламя при достижении стенок трубки преобразуется в плоский, узкий (толщиной менее 10-6 м) фронт, распространяющийся в сторону свежей смеси. Продукты сгорания, объем которых в результате повышения температуры в несколько раз превышает объем исходной смеси, истекает из трубки через открытый конец. Скорость перемещения фронта пламени по нормали к его поверхности называется нормальной скоростью распространения пламени. Нормальная скорость распространения пламени имеет минимально возможную величину, не зависит от условий, а зависит лишь от химического состава горючей смеси и соотношения горючего окислителя (максимальное значение нормальной скорости распространения пламени соответствует стехиометрическому соотношению компонентов горючей смеси). Этот показатель, строго говоря, является единственным из всех многочисленных характеристик пламени, имеющим характер физико-химической константы.
Если же закрыть свободный конец трубки, то горячие продукты сгорания будут, как поршень, давить на пламя и увеличивать скорость его перемещения. Суммарная скорость такого перемещения фронта пламени называется видимой скоростью пламени  , м/с и определяется выражением:
, м/с и определяется выражением:
 , (1.9)
, (1.9)
где  - нормальная скорость распространения пламени, м/с;
- нормальная скорость распространения пламени, м/с;
 - степень расширения продуктов сгорания.
- степень расширения продуктов сгорания.
Степень расширения продуктов сгорания  , вычисляют по формуле:
, вычисляют по формуле:
 , (1.10)
, (1.10)
где  ,
, 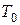 – температура горения и начальная температура, oС;
– температура горения и начальная температура, oС;
 - отношение числа молей продуктов сгорания к числу молей исходной смеси (величина
- отношение числа молей продуктов сгорания к числу молей исходной смеси (величина  для углеводородных горючих веществ близка к единице).
для углеводородных горючих веществ близка к единице).
В случае диффузионного горения, пламя как бы стоит на месте, а в него втекают с одной стороны горючие пары, с другой стороны – воздух. Наиболее характерным примером диффузионного пламени является горящая свеча.
Распространение пламени происходит путем переноса их фронта пламени в свежую горючую смесь потоков тепла молекулярной теплопроводностью и активных центров диффузий. Соотношение между этими потоками зависит от химической природы горючей смеси, развиваемой во фронте пламени температуры и условий распространения пламени. Для обычных горючих веществ и материалов (органических, т.е. на основе углеводородов и их производных), нижняя температурная граница пламени которых составляет около 1030 °С , максимальная температура горения может достигать 2230 °С, доминирующее значение приобретает перенос тепла.
Тепловая теория пламени, разработанная Я.Б.Зельдовичем, исходит из подобия полей концентраций и температур во фронте пламени.
Многочисленные опытные данные свидетельствуют, что скорость пламени углеводородо-воздушных смесей с давлением уменьшается по закону:
 , (1.11)
, (1.11)
где  - давление, Па.
- давление, Па.
Анализируя это выражение, можно видеть, что порядок реакции при горении таких смесей имеет дробную величину. Это свидетельствует о сложном немолекулярном механизме химических превращений в пламени.
|
из
5.00
|
Обсуждение в статье: Расход воздуха при горении |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

