 |
Главная |
Горение твердых веществ
|
из
5.00
|
Особенность горения твердых горючих веществ состоит в том, что при нагреве они частично разлагаются, образуя парогазовую горючую систему. Эту часть горючих веществ называют летучей. Для объяснения процессов горения летучих веществ применимы закономерности, используемые при горении газов и паров.
Под действием тепла, передаваемого от зоны горения на поверхность твердых веществ, происходит не только их выгорание, но и распространение пламени по еще не горящей поверхности. Горение твердых веществ в простейшем случае не сопровождается разложением вещества с выделением летучих компонентов (например, горение металлов). В технике большое значение имеет горение твердого топлива, главным образом углей, содержащих углерод и некоторое количество органических веществ, которые при нагревании топлива разлагаются и выделяются в виде паров и газов. При быстром нагревании частиц топлива (для частиц малого диаметра) летучие компоненты могут не успеть выделиться и сгорают вместе с углеродом. При медленном нагревании наблюдается четкая стадийность начального этапа горения – сначала выход летучих компонентов и их воспламенение, затем воспламенение и горение твердого, так называемого коксового остатка, который кроме углерода содержит минеральную часть топлива – золу.
Пожарная опасность твердых веществ и материалов характеризуется их склонностью к возгоранию и самовозгоранию. К возгоранию относятся случаи возникновения горения при воздействии внешних источников зажигания с температурой выше температуры самовозгорания. К самовозгоранию относятся случаи горения, возникающие при температуре окружающей среды.
Химический состав твердых горючих веществ очень разнообразен. Большинство из них относится к классу органических веществ, состоящих в основном из углерода, водорода, кислорода и азота. В состав многих органических веществ входят также хлор, фтор, кремний и другие химические элементы. Значительно меньшее количество твердых горючих веществ относится к классу неорганических веществ. Среди них металлы (калий, натрий, магний, алюминий, титан и др.), металлоиды (сера, фосфор, кремний), а также их соединения друг с другом.
В условиях большинства пожаров горят твердые вещества, которые широко используются в народном хозяйстве и быту. К ним в первую очередь относятся материалы, изготовленные на основе целлюлозы (таблица 1.4): древесина, хлопок, хлопчатобумажные ткани, бумага; на основе углеводородов и их производных: резина, пластмассы, химические волокна и ткани из них; продукты питания: зерно и зернопродукты, жиры, сахар и т. д.
Целлюлозные материалы, как видно из таблицы 1.4, содержат кислород, который участвует в процессе горения так же, как кислород воздуха. В связи с этим объем воздуха, теоретически необходимый для их горения, значительно меньше, чем для горения горючих веществ, в состав которых кислород не входит. Этим же объясняется низкая теплота сгорания целлюлозных материалов и способность их к тлению. Полости и поры волокнистых и пористых целлюлозных материалов, кроме того, заполнены воздухом, что способствует их горению. Горение таких веществ происходит без образования сажи.
Таблица 1.4 - Состав целлюлозных материалов
| Горючий материал | Вещества, входящие в состав целлюлозных материалов, % | |||||
| углерод | водород | кислород | азот | влага | сажа | |
| Древесина: дуб | 46,08 | 5,50 | 38,18 | 1,14 | 7,00 | 2,10 |
| сосна | 46,00 | 5,50 | 39,2 | 0,9 | 7,00 | 1,40 |
| Солома | 39,06 | 4,70 | 42,2 | 1,04 | 8,00 | 5,00 |
| Хлопок | 42,40 | 5,92 | 46,6 | 0,58 | 4,00 | 0,50 |
Характерным свойством целлюлозных материалов является их способность при нагревании разлагаться с образованием паров, газов и углеродистого остатка. Количество образующихся при этом газообразных продуктов (летучих) и их состав зависят от температуры и режима нагревания горючих веществ. Торф начинает разлагаться уже при температуре от 100 до 105 °С, заметное разложение протекает при 150 °С. Медленное разложение древесины начинается при температуре от 160 до 170 °С, а заметный выход газообразных продуктов происходит при температуре от 250 до 300 °С.
При начальной температуре разложения твердых веществ скорость образования газообразных продуктов небольшая, с повышением температуры она увеличивается. При дальнейшем повышении температуры скорость выделения газообразных продуктов уменьшается, приближаясь к некоторому минимальному значению. Таким образом, газообразные продукты при нагревании твердых веществ образуются в определенном интервале температур и с переменной скоростью, причем при разложении разных горючих материалов выделяется различное количество газообразных продуктов. Так, при разложении 1 кг древесины выделяется 800 г газообразных продуктов и образуется 200 г древесного угля, при разложении 1 кг торфа выделяется 700 г газообразных продуктов, а при разложении 1 кг хлопка - 850 г газообразных продуктов.
Состав газообразных продуктов разложения не постоянен, он изменяется в зависимости от температуры разложения твердых веществ. При низких температурах преобладает двуокись углерода и водяной пар, при более высоких образуются горючие газы: водород, метан и др. В таблице 1.5 приведен состав неконденсирующихся газов, образующихся при различной температуре разложения древесины.
Таблица 1.5 - Состав газов при разложении березовой древесины
| Температура, °С | ||||||
| Выход газов на 100 кг древесины, м3 | 0,4 | 5,6 | 9,5 | 12,8 | 14,3 | 16,0 |
| Состав газов, объемный процент | ||||||
| СО2 | 75,00 | 75,00 | 49,36 | 3,20 | 40,98 | 38,56 |
| СО | 25,00 | 40,17 | 34,00 | 29,01 | 27,20 | 25,19 |
| СН4 | - | 3,76 | 14,31 | 21,72 | 23,42 | 24,94 |
| С2Н4 | - | - | 0,86 | 3,68 | 5,74 | 8,50 |
| Н2 | - | - | 1,47 | 2,34 | 2,66 | 2,81 |
В таблице 1.6 приведен полный состав продуктов, получающихся при разложении березовой древесины. Если из них исключить уголь, то оставшиеся 68,2 весового процента составляют газообразные продукты, из которых около 30 % являются негорючими (вода и двуокись углерода), около 38 % - горючими. В таблице 1.6 приведены также количества тепла, выделяющегося при горении угля и газообразных продуктов, полученных при сухой перегонке древесины без доступа воздуха. Суммарное количество выделенного тепла при горении 1 кг древесины равно теплоте сгорания древесины. Согласно данным, приведенным в таблице 1.6, теплота сгорания березовой древесины равна 18750 кДж/кг.
При горении древесины в условиях пожара количество образующегося угля несколько меньше и составляет 20 весовых процентов от массы древесины.
Состав угля не постоянен и меняется в зависимости от температуры разложения. Так, при 150 °С уголь, образующийся при разложении древесины, содержит 51,7 % углерода, 5,9 % водорода и 42,4 % связанного кислорода, а при 450 °С - 84,9 % углерода, 3,1 % водорода и 12 % кислорода.
Таблица 1.6 - Теплота сгорания продуктов сухой перегонки березовой древесины
| Продукты сухой перегонки березовой древесины | Выход на 100 кг абсолютно сухой древесины (В), кг | Теплота сгорания, МДж | |
| 1 кг (z) | 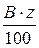
| ||
| Уголь | 31,80 | 32,2 | 10,2 |
| Смола | 15,80 | 29,6 | 4,7 |
| Уксусная кислота | 7,08 | 14,3 | 1,0 |
| Метиловый спирт | 1,60 | 22,2 | 0,4 |
| Ацетон | 0,19 | 32,5 | 0,06 |
| СО2 | 9,96 | - | - |
| СО | 3,32 | 10,1 | 0,3 |
| СН4 | 0,54 | 50,0 | 0,3 |
| С2Н4 | 0,19 | 47,1 | 0,09 |
| Разные органические вещества | 10,03 | 16,2 | 1,7 |
| Вода | 19,49 | - | - |
| Итого: | 100,00 | - | 18,75 |
Разложение целлюлозных материалов сопровождается выделением тепла, поэтому при малой скорости теплоотвода возможно самонагревание их и возникновение горения. Самый высокий тепловой эффект разложения у древесины (1090 кДж/кг), поэтому надо следить, чтобы она не нагревалась в больших массах (при плотной укладке) выше 100 °С.
Таблица 1.7 - Удельная весовая скорость выгорания некоторых материалов
| Горючие материалы | Удельная весовая скорость выгорания, кг/(м2 · мин) | Принимаемая скорость выгорания, кг/(м2·мин) | ||
| при 500 °С | при 700 °С | при 900 °С | ||
| Древесина (влага до 10%) | 0,34 | 0,45 | 0,65 | 0,5 |
| Стеклопластик | 0,74 | 0,90 | 1,10 | 1,0 |
| Каучук СКИ-3 | 0,45 | 0,85 | - | 1,12 |
Как и при горении жидкостей, весовую скорость выгорания твердых веществ относят к единице поверхности горения, т. е. поверхности горючего вещества, с которой в данный момент времени в зону горения поступают пары и газы. Такая весовая скорость выгорания твердых веществ называется удельной. Удельная весовая скорость выгорания не зависит от величины поверхности твердых веществ и изменяется в зависимости от температуры и влажности вещества (таблица 1.7).
Практическое определение удельной скорости выгорания твердых материалов очень затруднено, так как поверхность горения многих из них не представляет ровную плоскость. В связи с этим принято скорость выгорания принимать с единицы площади пожара, т. е. единицы площади проекции поверхности горения на горизонтальную плоскость. Такую величину принято называть приведенной весовой скоростью выгорания и обозначать 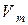 (таблица 1.8).
(таблица 1.8). 
Таблица 1.8 – Приведенные весовые скорости выгорания твердых веществ
| Вещество | Приведенная весовая скорость выгорания, кг /(м2 · мин) |
| Бумага разрыхленная | 0,48 |
| Древесина (конструкции здания, мебель) | 0,84 |
| Пиломатериалы в штабеле | 7,0 - 8,0 |
| Резино-технические изделия | 0,67 |
| Текстолит | 0,4 |
| Хлопок разрыхленный | 0,24 |
Эту величину можно определять опытным путем на специальной установке, называемой камера-весы.
Под действием тепла, передаваемого от зоны горения на поверхность твердых материалов, происходит не только их выгорание, но и перемещение фронта пламени по еще негорящей поверхности. Перемещение фронта пламени по поверхности твердых веществ называется распространением горения и характеризуется линейной скоростью распространения горения 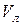 :
:
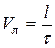 , (1.28)
, (1.28)
где  - расстояние, пройденное фронтом пламени, м;
- расстояние, пройденное фронтом пламени, м;
 - время перемещения фронта пламени, мин.
- время перемещения фронта пламени, мин.
Различают две линейные скорости распространения горения - по вертикальной поверхности (вниз и вверх) и горизонтальной поверхности. Однако, в расчетах по тушению пожаров практически применяется только скорость распространения по горизонтальной поверхности. На величину линейной скорости распространения горения влияет много факторов: состояние поверхности вещества, интенсивность излучения зоны горения, направление и скорость ветра и др.
Твердые материалы при хранении на открытой местности и в зданиях располагают, как правило, не сплошным слоем, а с разрывами, достигающими иногда нескольких метров. Однако в условиях пожара такие разрывы не могут предотвратить распространение горения. В связи с этим, при определении линейной скорости распространения горения во время пожара в расстояние, пройденное фронтом горения в данном направлении, включают и разрывы между скоплениями горючих материалов, если они не препятствовали распространению горения.
Таким образом, линейная скорость распространения горения в условиях пожара отличается от линейной скорости распространения горения по поверхности твердого горючего вещества. В таблице 1.9 приведены наблюдаемые линейные скорости распространения горения в условиях пожара при горении различных материалов.
Таблица 1.9 - Линейные скорости распространения горения в условиях пожара при горении твердых веществ
| Вещество | Линейные скорости распространения горения в условиях пожара, м/мин |
| Бумага в рулонах | 0,27 |
| Резиново-технические изделия | 1,10 |
| Синтетический каучук | 0,40 |
| Текстильные изделия | 0,38 |
| Штабели торфоплит | 1,00 |
| Штабели досок (влага от 8 до 10 %) | 4,00 |
Горение металлов
Почти все металлы, металлоиды и их соединения при нагревании плавятся и образуют над поверхностью слой паров. Горение металлов во многом зависит от их температуры плавления и кипения, а также температуры плавления и кипения их окислов. По характеру горения металлы делятся на две группы: летучие и нелетучие. Летучие металлы и их свойства приведены в таблице 1.10.
Все эти металлы имеют низкую температуру плавления и при горении находятся в жидком состоянии. Температура их кипения (кроме калия) ниже температуры плавления окислов, поэтому на жидком металле могут находиться твердые окислы.
При контакте металлов с источником воспламенения, например, пламенем, они нагреваются и окисляются. Окислы всех металлов, приведенных в таблице 1.10, пористые и не способны изолировать поверхность металла от дальнейшего окисления, а, следовательно, и нагревания. Через некоторое время металл расплавляется и начинает испаряться. Пары его диффундируют сквозь пористый твердый окисел в воздух. Когда концентрация паров в воздухе достигнет нижнего предела воспламенения, возникает горение. Зона диффузионного горения устанавливается вблизи поверхности окисла и большая часть теплоты реакции передается металлу, в результате чего он нагревается до температуры кипения. Кипение металла вызывает разрыв корки окисла и более интенсивное горение.
Таблица 1.10 - Свойства летучих металлов и их окислов
| Металлы | Температура, °С | Окислы металлов | Температура плавления, °С | |
| плавления | кипения | |||
| Li | Li2O | |||
| Na | Na2O | |||
| K | K2O | разлагается при 300-400 | ||
| Mg | MgO | |||
| Ca | CaO |
Так как температура горения летучих металлов превышает температуру кипения их окислов, последние находятся в зоне горения в газообразном состоянии. Из зоны горения пары окислов диффундируют как в твердую корку окислов, так и в воздух, где они, охлаждаясь, конденсируются и превращаются затем в мельчайшие твердые частицы окисла - дым. Образование белого плотного дыма является одним из признаков горения летучих металлов.
Нелетучие металлы имеют свои особенности горения (таблица 1.11).
Таблица 1.11 - Свойства нелетучих металлов и их окислов
| Металлы | Температура, °С | Окислы металлов | Температура, °С | ||
| Плавления | кипения | плавления | кипения | ||
| Al | Al2O3 | ||||
| Be | BeO | ||||
| Тi | TiO2 |
Из данных таблицы 1.11 видно, что окислы часто имеют температуру плавления ниже температуры кипения металлов, поэтому они могут находиться на поверхности металла в жидком состоянии. В связи с этим окислы в значительной степени замедляют окисление металлов. Горение этих металлов происходит энергичнее в состоянии порошков, аэрозолей и стружки без образования дыма.
Титан способен образовывать твердый раствор окисла в металле, поэтому у него отсутствует отчетливая поверхность раздела между окислом и металлом. Кислород воздуха имеет возможность диффундировать через окисел, в результате чего горение может продолжаться, если титан покрыт слоем твердой окиси. Температура горения титана около 3000 °С, т. е. ниже, чем температура кипения его окисла. В связи с этим в зоне горения окись титана находится в жидком состоянии, поэтому при горении титана плотного белого дыма также не образуется.
Многие металлы и сплавы способны загораться. Отдельные металлы, которые обычно считаются негорючими, воспламеняются и горят в мелко раздробленном состоянии. Аэрогели и аэрозоли многих металлов пожаро- и взрывоопасны, известны разрушительные промышленные взрывы металлической пыли.
В связи с применением металлов в высокотемпературных и коррозионных средах, в реактивных двигателях, в качестве ракетного топлива потребовались более глубокие исследования горения металлов. Особый интерес представляют исследования металлов как горючего в связи с проблемой завоевания межпланетных пространств (Цандер Ф.А. «Проблема полета при помощи реактивных аппаратов», 1932 г.; Кондратюк Ю.В. «Завоевание межпланетных пространств», 1929 г.). Активное развитие эти исследования получили в последние 60 лет.
Горение металла - это экзотермический гетерогенный процесс, при котором одно из реагирующих веществ - металл (сплав) - находится в твёрдой фазе, а другое - окислитель - в окружающей среде. Продукты реакции могут находиться в твёрдом, жидком и газообразном состоянии.
Скорость гетерогенного химического процесса не может возрастать неограниченно, она определяется как истинной скоростью протекания химической реакции на поверхности металла, так и скоростью подвода реагирующих веществ к этой поверхности благодаря диффузии. При низких температурах, когда скорость реакции мала по сравнению со скоростью диффузии (кинетическая область), суммарная скорость процесса определяется истиной кинетикой на поверхности металла и экспоненциально возрастает с повышением температуры (согласно закону Аррениуса) до тех пор, пока скорость химической реакции не станет сравнимой со скоростью диффузии. После этого процесс переходит в диффузионную область, и скорость его определяется скоростью диффузии, весьма слабо возрастая с повышением температуры.
Кривая 1 (рисунок 1.9) показывает изменение скорости реакции или пропорционально ей скорости теплоприхода (т. е. количества тепла, выделяющегося на единице поверхности за единицу времени). Нижняя часть этой кривой соответствует кинетической области, в которой скорость реакции экспонециально возрастает с повышением температуры и не зависит от скорости газового потока.
Верхняя часть кривой соответствует диффузионной области, в которой скорость реакции слабо возрастает с повышением температуры, но значительно зависит от скорости газового потока. Пунктирные кривые соответствуют скоростям реакции при разных скоростях газового потока (чем больше скорость, тем выше положение кривой).
Кривые 2 (2', 2'', 2''') соответствуют разным скоростям теплоотвода с поверхности металла. Так как даже теплоотдача лучеиспусканием гораздо меньше зависит от температуры, чем скорость химической реакции, то в незначительных интервалах температур кривые 2', 2'', 2''' можно считать прямолинейными.
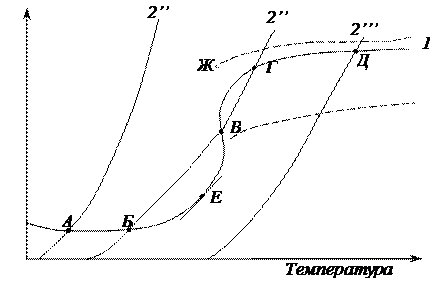
Рисунок 1.9 - Стационарные термические режимы поверхности
|
из
5.00
|
Обсуждение в статье: Горение твердых веществ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

