 |
Главная |
Тепловая теория горения
|
из
5.00
|
Первой хронологически (конец ХIХ века) была тепловая теория, основоположниками которой считаются Маляр, Ле Шателье и Нуссельт. В основу этой теории положена гипотеза Вант-Гофа о температурной зависимости скорости химической реакции. Условием теплового взрыва является преобладание теплоприхода за счет энергии реакции над отводом тепла в окружающую среду. В этом случае в системе накапливается тепло, что приводит к саморазогреву и соответственно к саморазгону реакции.
Возникновение в горючей системе реакции окисления связано чаще всего с нагреванием системы тем или иным источником воспламенения. При нагревании горючей системы энергия молекул горючего и кислорода увеличивается и, когда она достигает некоторой величины, происходит их активизация, т.е. образуются активные центры (радикалы и атомы), имеющие свободные валентности, в результате чего молекулы горючего вещества легко вступают в соединение с кислородом воздуха. А.Н. Бах и К. Энглер в 1898 г. независимо друг от друга предложили перекисную теорию окисления, согласно которой при нагревании горючей системы происходит активизация кислорода путём разрыва одной связи между атомами, причём активная молекула вступает в соединение с горючим веществом, не распадаясь на атомы и образуя перекисные соединения типа: R1-O-O-R2 или R-O-O-OH.
Однако, перекисная теория не в состоянии объяснить некоторые характерные особенности процесса окисления, например, резкое действие, иногда ничтожных следов посторонних примесей.
Скорость химической реакции 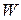 , м/с может быть выражена, исходя из закона Аррениуса, следующим уравнением:
, м/с может быть выражена, исходя из закона Аррениуса, следующим уравнением:
 , (1.12)
, (1.12)
где 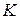 - константа скорости реакции (скорость химической реакции при концентрациях реагентов, приведенных к единице);
- константа скорости реакции (скорость химической реакции при концентрациях реагентов, приведенных к единице);
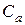 ,
,  ,
,  - концентрации реагентов, моль/м3;
- концентрации реагентов, моль/м3;
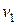 ,
,  ,
, 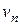 - стехиометрические коэффициенты, определяемые соотношением концентраций исходных реагентов в стехиометрическом уравнении реакции;
- стехиометрические коэффициенты, определяемые соотношением концентраций исходных реагентов в стехиометрическом уравнении реакции;
 - основание натуральных логарифмов;
- основание натуральных логарифмов;
 - энергия активации, Дж/моль;
- энергия активации, Дж/моль;
 - универсальная газовая постоянная,
- универсальная газовая постоянная,  = 8,3 Дж/(моль∙К);
= 8,3 Дж/(моль∙К);
 – температура, К.
– температура, К.
Тепловая теория самовоспламенения (называемая также теорией теплового взрыва) основана на сопоставлении скоростей процессов тепловыделения при экзотермическом окислении и теплоотвода от реагирующей смеси в стенке содержащего его сосуда. Условие самовоспламенения определяется равенством этих скоростей. Температура стенок сосуда, при которой достигается это равенство, называется температурой самовоспламенения. Начиная с этой температуры (характерной в каждом случае для данных конкретных условий - размера и формы сосуда, теплофизических свойств газа) происходит саморазогрев, который может привести к вспышке (самовоспламенению).
С учётом изложенного для саморазогрева в реагирующей среде можно записать:
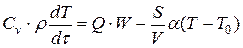 , (1.13)
, (1.13)
где 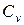 - теплоемкость при постоянном объёме, Дж/К ;
- теплоемкость при постоянном объёме, Дж/К ;
 - плотность газа, кг/м3;
- плотность газа, кг/м3;
 - температура газа, К;
- температура газа, К;
 - время, с;
- время, с;
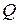 - тепловой эффект реакции, Вт;
- тепловой эффект реакции, Вт;
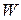 - скорость реакции, м/с;
- скорость реакции, м/с;
 - поверхность реакционного сосуда, м2;
- поверхность реакционного сосуда, м2;
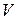 - объем реакционного сосуда, м3;
- объем реакционного сосуда, м3;
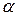 - коэффициент теплоотдачи, Вт/( м2×К);
- коэффициент теплоотдачи, Вт/( м2×К);
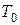 - температура стенки сосуда, К.
- температура стенки сосуда, К.
Д.А.Франк-Каменецким был предложен критерий теплового самовоспламенения, основанный на нарушении стационарного распределения температур в реактивном сосуде при достаточной скорости тепловыделения:
 , (1.14)
, (1.14)
где 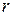 - характерный размер сосуда, м;
- характерный размер сосуда, м;
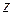 - предэкспоненциальный множитель;
- предэкспоненциальный множитель;
 - коэффициент теплопроводности газовой смеси, Вт/(м×К);
- коэффициент теплопроводности газовой смеси, Вт/(м×К);
 - безразмерный критерий, равный 3,3; 0,88 и 2 соответственно для сферического, плоскопараллельного и цилиндрического сосудов.
- безразмерный критерий, равный 3,3; 0,88 и 2 соответственно для сферического, плоскопараллельного и цилиндрического сосудов.
Критерий Д.А.Франк-Каменецкого следует понимать так: если при подстановке всех параметров, определяющих  , мы получим значение
, мы получим значение 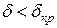 , то воспламенения не будет, при
, то воспламенения не будет, при 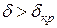 произойдет воспламенение. Из уравнения критерия следует, что теплота реакции
произойдет воспламенение. Из уравнения критерия следует, что теплота реакции 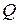 и радиус сосуда
и радиус сосуда 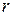 , в котором происходит реакция, - важные определяющие факторы взрыва. Тепловой взрыв выражен тем ярче, чем лучше выполняются неравенства:
, в котором происходит реакция, - важные определяющие факторы взрыва. Тепловой взрыв выражен тем ярче, чем лучше выполняются неравенства:
 << 1
<< 1
Если эти неравенства выполняются плохо, то тепловой взрыв вырождается – одновременно с ростом температуры происходит быстрое выгорание исходного вещества, которое смазывает картину взрыва.
Возникновение горения чаще всего связано с нагреванием горючей системы тем или иным источником воспламенения. Согласно теории академика Н.Н. Семёнова, процесс окисления сопровождается выделением тепла и при определенных условиях может самоускоряться. Этот процесс самоускорения реакции окисления с переходом её в горение называется самовоспламенением.
В случае теплового самовоспламенения оно возникает вследствие превышения скорости тепловыделения над скоростью теплоотвода.
Рассмотрим процесс теплового самовоспламенения на примере горючего газа или паров горючей жидкости с воздухом, помещенных в сосуд объёмом 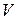 . При повышении температуры сосуда и горючей смеси скорость реакции и выделение тепла увеличится. Зависимость скорости выделения тепла от температуры
. При повышении температуры сосуда и горючей смеси скорость реакции и выделение тепла увеличится. Зависимость скорости выделения тепла от температуры 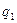 , Дж/с определяются:
, Дж/с определяются:
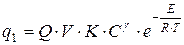 , (1.15)
, (1.15)
где 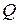 - теплота сгорания газа, Дж;
- теплота сгорания газа, Дж;
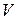 - объём горючей смеси, м3;
- объём горючей смеси, м3;
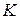 - константа скорости реакции;
- константа скорости реакции;
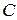 - концентрация реагирующего вещества, кг/м 3;
- концентрация реагирующего вещества, кг/м 3;
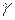 - порядок реакции;
- порядок реакции;
 - энергия активации, Дж/моль;
- энергия активации, Дж/моль;
 - универсальная газовая постоянная Дж/(моль·К);
- универсальная газовая постоянная Дж/(моль·К);
 - температура смеси, К.
- температура смеси, К.
Выделяющееся тепло передаётся горючей смеси, и она нагревается. Как только температура смеси превысит температуру стенок сосуда, начнётся отвод тепла через стенки сосуда в единицу времени, пропорционально разности температур смеси и стенок сосуда и определяются зависимостью:
 , (1.16)
, (1.16)
где  - скорость отвода тепла через стенки сосуда, Дж/с;
- скорость отвода тепла через стенки сосуда, Дж/с;
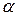 - коэффициент теплопередачи, Дж/(К·м2 ×с);
- коэффициент теплопередачи, Дж/(К·м2 ×с);
 - поверхность стенок сосуда, м2;
- поверхность стенок сосуда, м2;
 - температура смеси, К;
- температура смеси, К;
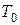 - температура стенок сосуда, К
- температура стенок сосуда, К

Рисунок 1.5 – Зависимость тепловыделения от температуры при разных давлениях
На рисунке 1.5 кривые 2, 3 и 4 показывают зависимость тепловыделения от температуры при разных давлениях и одинаковом составе смеси. При постоянных температурах сосуда и среды и постоянном составе смеси количество отводимого из зоны горения тепла характеризуется прямой 1. При изменении состава смеси изменится и скорость теплопотерь и, следовательно, наклон прямой. Чем выше давление, тем больше выделяется тепла при реакции (кривая 4). В условиях, определяемых кривой 2, самовоспламенение возникнуть не может, так как теплопотери (прямая 1) выше тепловыделений при этом давлении. Точка касания кривой 3 с прямой соответствует равновесию между выделяемым и отводимым теплом при 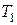 - минимальной температуре самовоспламенения данной горючей системы в заданных условиях. При незначительном подводе энергии извне возможно самовоспламенение. Кривая 4 характеризует условия, при которых неизбежно самовоспламенение, так как выделяется тепло больше, чем отводится.
- минимальной температуре самовоспламенения данной горючей системы в заданных условиях. При незначительном подводе энергии извне возможно самовоспламенение. Кривая 4 характеризует условия, при которых неизбежно самовоспламенение, так как выделяется тепло больше, чем отводится.
Анализируя приведённую схему, Н.Н. Семёнов установил зависимость:
 , (1.17)
, (1.17)
где  - минимальное давление воспламенения, Па;
- минимальное давление воспламенения, Па;
 - минимальная температура самовоспламенения, К;
- минимальная температура самовоспламенения, К;
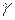 - порядок реакции;
- порядок реакции;
 - постоянная, зависящая от состава и других свойств смеси.
- постоянная, зависящая от состава и других свойств смеси.
На основании этого уравнения (1.17) можно теоретически заранее определить, возможно ли самовоспламенение горючей смеси в данных конкретных условиях. Соотношение, связывающее минимальное давление с температурой самовоспламенения, было подтверждено многочисленными экспериментами и оказалось ценным при изучении процессов горения.
Цепная теория горения
Еще в 1928 г. Н.Н.Семенов выдвинул идею о возможности существования в химических системах двух типов взрывов – цепных и тепловых.
Цепными называются реакции, идущие через ряд стадий (через ряд промежуточных реакций), в которых образуются промежуточные соединения со свободными валентностями, так называемые активные центры, являющиеся зародышами последующих быстропротекающих стадий процесса.
Впервые представление о цепной реакции появилось в 1913 г., когда немецкий физико-химик М. Боденштейн установил, что при освещении смеси водорода с хлором молекула хлора, поглощая квант световой энергии  , распадается на атомы:
, распадается на атомы:
 .
.
Атомы хлора мгновенно вступают в реакцию с водородом, в результате чего происходит взрыв смеси. Активация одной молекулы хлора должна была бы вызвать образование двух молекул 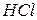 :
:
 .
.
Однако, опыты показывают, что при этом образуется 100000 молекул хлористого водорода. Это можно объяснить, если предположить, что при взаимодействии хлора с водородом образуется продукт, который, вступая во вторичные реакции, вновь возрождается и может продолжать реакцию. Этому предположению соответствует такая схема реакции:
I 
 Первичная реакция
Первичная реакция
 II
II 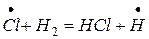
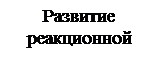 III
III 
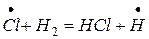

и т.д.
IV  Обрыв цепи
Обрыв цепи
V 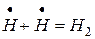
По этой схеме активация одной молекулы хлора (I) вызывает появление двух атомов хлора – двух активных центров цепной реакции. Каждый из атомов хлора дает начало своей цепной реакции, в которой активный центр непрерывно восстанавливается (II, III). Таким образом, под влиянием инициирующей реакции (I) возникают следующие друг за другом реакции, образующие цепь (II, III и т.д.). Число таких реакций от момента зарождения цепи до ее обрыва называют длиной цепи. Цепь может обрываться при столкновении атомов хлора (IV) или атомов водорода (V) и образования из них молекул, или при столкновении активных центров с поверхностью твердого вещества. Это типичная неразветвляющаяся цепная реакция. В ней каждый активный центр вызывает появление только одного нового активного центра, поэтому реакция может продолжаться, но не ускоряться.
В разветвляющейся цепной реакции каждый активный центр зарождает два и более новых активных центра.
Согласно теории цепных реакций, процесс окисления начинается с активизации горючего вещества.
Практика показала, что воспламенение может происходить в изотермических условиях, т.е. без повышения температуры реагирующей среды («холодное» воспламенение смеси). В этом случае говорят о цепном (изометрическом) взрыве.
Два исходных компонента: горючее и окислитель, находясь в относительно устойчивом молекулярном состоянии, прежде чем ассоциироваться в новые, более устойчивые молекулы продуктов горения, претерпевают целую цепь сложных промежуточных превращений, результатом которых является образование неустойчивых продуктов: атомов, радикалов, возбужденных молекул с относительно большой степенью ионизации (формальдегид, углеводородный и гидрокислый радикалы, атомарный кислород и водород).
Кондратьеву В.Н. удалось обнаружить в пламени различных углеводородов большие концентрации атомарного кислорода (О), гидрокислого радикала (ОН), углеводородных радикалов (СН3), окиси углерода (СО), формальдегида (СН2О) и др. Концентрации этих веществ в пламени оказались в тысячи и миллионы раз большими их равновесных концентраций при термическом разложении при температуре пламени конечных продуктов реакции, например, Н2О → Н+ОН.
Результаты этих наблюдений позволили сделать вывод, что рассматриваемые атомы и радикалы появляются в реагирующем газе не вследствие конечного распада продуктов, а являются промежуточными продуктами реакции.
Таким образом, в основе цепного механизма воспламенения лежит целая цепь химических превращений одних веществ в другие, результатом которых является образование на отдельных промежуточных стадиях химически очень активных неустойчивых продуктов, получивших название активных центров, которые легко реагируют между с собой и с молекулами исходных веществ с образованием новых активных центров и конечных продуктов, например, для метановоздушной смеси Н2О и СО2.
Высокая реакционная способность радикалов и атомов объясняется малой энергией активизации их реакций, близкой к энергии активации атомных реакций:
ОН + Н2 = Н2О + Н - 25 кДж/моль
СН3 + С3Н6 - 12,5 кДж/моль
СН3 + С6Н6 - 23,5 кДж/моль
Н2О → Н + ОН
Любая из полученных активных частиц (Н или ОН) будучи крайне неустойчивой и, следовательно, химически активной, сталкиваясь с молекулой исходного вещества, расщепляется, образуя новые активные частицы:
Н+О2 = ОН+О
ОН+Н2 = Н2О+Н
Полученные в результате реакции активные частицы Н и ОН снова вступят в реакции, а частицы О взаимодействуют с водородом:
О+Н2 = ОН+Н.
Т.е., в результате реакции между активными частицами и молекулами исходных веществ образуются не только конечные продукты, но и новые активные частицы. Образующиеся в результате реакции активные частицы дают начало новым стадиям химического превращения, которые будут происходить до полного расхода исходных веществ.
Такие многократно повторяющиеся химические реакции называются цепными, а активные частицы, дающие начало новым цепям превращений, активными центрами.
Рассмотренный выше цепной процесс горения водорода можно представить в виде схемы (рисунок 1.6).
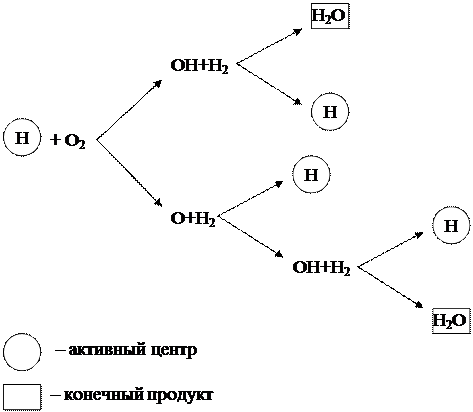
Рисунок 1.6 - Схема цепного горения водорода
Из схемы видно, что начало новым цепям превращений дают только частицы водорода (Н), которые являются активными центрами. При этом в каждом звене цепного процесса в результате реакции между активным центром Н и молекулой кислорода О2 кроме конечного продукта Н2О образуются 3 новых активных центра Н, дающие начало новым цепям превращений.
Такая цепная реакция, протекающая с увеличением активных центров, называется разветвлённой. Реакция развивается лавинообразно и протекает с очень высокими скоростями, значительно превышающими скорость обычных молекулярных реакций.
Типичной реакцией с неразветвляющейся цепью является взаимодействие хлора с водородом. Активными центрами этой реакции служат чередующиеся атомы хлора и водорода. При реагировании атома хлора образуется один атом водорода так же, как при реагировании атома водорода образуется один атом хлора. Поэтому реакция может продолжаться, но не ускоряться.
Тот общеизвестный факт, что фотохимическая реакция хлора с водородом всё же оканчивается взрывом (самовоспламенением), объясняется тем, что при достаточно большой скорости цепной реакции тепловыделения превышают теплоотвод, в результате чего смесь сильно нагревается, и возникают условия, необходимые для теплового самовоспламенения.
При протекании разветвлённой цепной реакции, которая характерна для углеводородов, концентрация активных центров может возрастать независимо от условий начального инициирования и, если скорость образования активных центров при разветвлениях превосходит скорость обрыва цепи, то возникает самоускоряющийся процесс лавинообразного характера, приводящий к воспламенению.
Теория цепных реакций позволила объяснить многие особенности процессов горения (сильное влияние примесей, пределы самовоспламенения по давлению, катализ и ингибирование давления и др.), которые нельзя объяснить тепловой теорией. Механизм возникновения и развития реальных пожаров и взрывов характеризуется комбинированным цепочечно-тепловым процессом. Начавшись цепным путём, реакция окисления за счёт её экзотермичности продолжает ускоряться тепловым путём. Поэтому, в конечном счете, критические (предельные) условия возникновения и развития горения будут определяться тепловыделением и условиями теплообмена реагирующей системы с окружающей средой.
На цепных химических реакциях основаны многие технологические процессы в химической промышленности. К таким процессам относятся, например, процессы полимеризации, составляющие основу производства синтетических каучуков, пластмасс, полимерных волокон и многих других изделий. К ним также относятся такие важные промышленные процессы, как производство синтетических жирных кислот, заменяющих ранее применяемые пищевые жиры в производстве моющих смазочных средств, крекинг – процесс получения высококачественного топлива из нефти и т. д.
|
из
5.00
|
Обсуждение в статье: Тепловая теория горения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

