 |
Главная |
Модель атома водорода по Бору
|
из
5.00
|
Лекции 3,4
Опыты Резерфорда по рассеянию альфа-частиц
Большую роль в развитии представлений о строении атома сыграли опыты английского физика Э.Резерфорда по рассеянию альфа частиц в веществе. Альфа-частицы, как было показано опытами, являются дважды ионизованными атомами гелия.
При прохождении быстрых альфа-частиц в веществе большая часть испытывает отклонение на 2-3 градуса. Однако около 0,01% отклоняется на углы, достигающие 180 градусов. Все альфа-частицы, вылетающие из атомов данного сорта, имеют практически одинаковую скорость. Кроме того, они обладают большой массой. Это особенно важно, т.к. они не могут отклоняться при столкновении с электронами и по рассеянию альфа-частиц в веществе можно судить о распределении положительно заряженной материи в атоме.
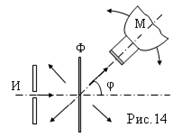 Особый интерес представляют опыты сотрудников Резерфорда - Гейгера и Марсдена, исследовавших рассеяние в тончайшей металлической фольге (золото, серебро и т.д.). Толщина фольги около 4 мкм. Выделенный тонкий пучок от источника альфа-частиц (И), рис.14, рассеивался при прохождении через фольгу Ф. Рассеянные альфа - частицы регистрировались по вспышкам (сцинцилляциям) на экране, укрепленном на объективе микроскопа М. Экран покрывался флюоресцирующим веществом. Микроскоп поворачивался для определения количества частиц, рассеянных под разными углами j.
Особый интерес представляют опыты сотрудников Резерфорда - Гейгера и Марсдена, исследовавших рассеяние в тончайшей металлической фольге (золото, серебро и т.д.). Толщина фольги около 4 мкм. Выделенный тонкий пучок от источника альфа-частиц (И), рис.14, рассеивался при прохождении через фольгу Ф. Рассеянные альфа - частицы регистрировались по вспышкам (сцинцилляциям) на экране, укрепленном на объективе микроскопа М. Экран покрывался флюоресцирующим веществом. Микроскоп поворачивался для определения количества частиц, рассеянных под разными углами j.
На угол более 90 градусов отклонялась примерно одна из 20000 частиц. Некоторые отклонялись почти на 180 градусов. Теоретическое исследование показало, что это не может являться результатом многократных отклонений на малые углы. Резерфорд пришел к заключению, что отклонение происходит в результате однократного взаимодействия альфа-частицы с положительным зарядом. Этот положительный заряд связан с большой массой, заключенной в очень малом объеме по сравнению с объемом атома в целом. В первом приближении (неподвижный атом) отклонение альфа-частицы можно описать как результат отталкивания от положительного заряда.
Следовательно, основная масса атома локализована в очень малом объеме, причем этот малый объем несет на себе весь положительный заряд атома. Исходя из этого, Резерфорд предложил ядерную (планетарную) модель атома.
Планетарная модель атома
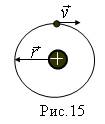
В данной модели в центре атома находится положительно заряженное ядро, масса которого почти равна массе атома. Вокруг ядра под действием электрических сил движутся легкие электроны.
 Т.к. кулоновские силы убывают с расстоянием по тому же закону, что и силы ньютоновского тяготения
Т.к. кулоновские силы убывают с расстоянием по тому же закону, что и силы ньютоновского тяготения 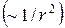 , то атом, по представлениям Резерфорда, подобен солнечной системе. Поэтому и возникло название - планетарная модель, рис.15. Т.к. атомы электрически нейтральны то при заряде +Ze вокруг ядра должны двигаться Z электронов. Для электрона, движущегося по определенной орбите, наблюдается действие на него центростремительной силы, которой в данном случае является сила кулоновского притяжения:
, то атом, по представлениям Резерфорда, подобен солнечной системе. Поэтому и возникло название - планетарная модель, рис.15. Т.к. атомы электрически нейтральны то при заряде +Ze вокруг ядра должны двигаться Z электронов. Для электрона, движущегося по определенной орбите, наблюдается действие на него центростремительной силы, которой в данном случае является сила кулоновского притяжения:
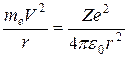 ,
,
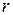 - радиус орбиты,
- радиус орбиты, 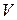 - скорость электрона на орбите,
- скорость электрона на орбите, 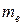 - масса электрона. Однако эта модель имела ряд существенных недостатков:
- масса электрона. Однако эта модель имела ряд существенных недостатков:
· уравнение содержит два неизвестных 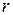 и
и 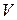 им отвечает бесконечное множество орбит на различных расстояниях от ядра. Любому значению
им отвечает бесконечное множество орбит на различных расстояниях от ядра. Любому значению 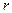 соответствует определенная скорость
соответствует определенная скорость  и энергия Е электрона на данной орбите. Эти величины могут меняться непрерывно и при переходе с одной орбиты на другую может испускаться любая, а не вполне определенная порция энергии. Согласно этой модели спектр должен быть сплошным, а не линейчатым.
и энергия Е электрона на данной орбите. Эти величины могут меняться непрерывно и при переходе с одной орбиты на другую может испускаться любая, а не вполне определенная порция энергии. Согласно этой модели спектр должен быть сплошным, а не линейчатым.
· согласно записанному выше равенству центростремительной и кулоновской силы модель механически устойчива. Однако она оказалась неустойчивой с точки зрения классической электродинамики. Электроны как частицы, несущие отрицательный заряд и движущиеся по круговым орбитам, обладают нормальным ускорением:
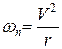
При радиусе орбиты равной 10 -10 м можно оценить скорость и частота обращения электрона равна: 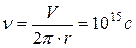 . При таких огромных ускорениях электроны должны интенсивно излучать электромагнитные волны. Их энергия будет быстро уменьшаться, вследствие чего они должны непрерывно приближаться к ядру и в конечном итоге должны упасть на него. Следовательно, данная модель непригодна для описания водородоподобного атома. Задача создания модели, описывающей закономерности спектра водорода была решена Бором.
. При таких огромных ускорениях электроны должны интенсивно излучать электромагнитные волны. Их энергия будет быстро уменьшаться, вследствие чего они должны непрерывно приближаться к ядру и в конечном итоге должны упасть на него. Следовательно, данная модель непригодна для описания водородоподобного атома. Задача создания модели, описывающей закономерности спектра водорода была решена Бором.
Постулаты Бора
Наличие линейчатого спектра и закономерности, наблюдаемые в этих спектрах находятся в противоречии с классической моделью Резерфорда. Первая попытка построения неклассической теории атома была предпринята датским ученым Н.Бором (1913). Он дополнил классические представления ограничениями на их возможные состояния в атоме, сформулированными в виде постулатов:
Первый постулат Бора. (Постулат стационарных состояний). Существуют некоторые стационарные состояния атома, находясь вкоторых он не излучает энергии. Т.е. существуют орбиты, находясь на которых электрон не излучает энергии.
Второй постулат Бора. (Правило квантования орбит). В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса,удовлетворяющие условию: 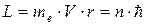 , где n = 1,2,3,...; mе - массаэлектрона, V - скорость, r - радиус обиты,
, где n = 1,2,3,...; mе - массаэлектрона, V - скорость, r - радиус обиты, 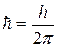 .
.
Третий постулат Бора. (Правило частот). При переходе атома из одного стационарного состояния в другоеиспускается или поглощается один фотон. Излучение происходит при переходе атома из состояния с большей энергией в состояние с меньшей энергией (при переходе электрона с орбиты, более удаленной от ядра, на более ближнюю к ядру орбиту). Изменение энергии, связанное с излучением или поглощением, пропорционально частоте:
 или же:
или же: 
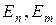 - энергии атомов в двух стационарных состояниях, если
- энергии атомов в двух стационарных состояниях, если 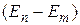 больше нуля - излучение,
больше нуля - излучение, 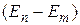 меньше нуля – поглощение фотона.
меньше нуля – поглощение фотона.
Первый и третий постулаты Бора связаны с невозможностью классического обоснования ядерной модели, а также со спектральными закономерностями в атоме водорода.
Модель атома водорода по Бору
Рассмотрим движение электрона, движущегося по круговой орбите радиуса 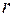 вокруг ядра с зарядом
вокруг ядра с зарядом  . При
. При 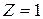 - это атом водорода. При
- это атом водорода. При 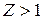 - это водородоподобный ион. На частицу, движущуюся по кругу рис.16, действует центростремительная сила:
- это водородоподобный ион. На частицу, движущуюся по кругу рис.16, действует центростремительная сила:
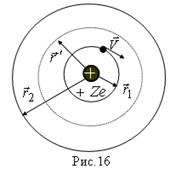
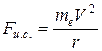
В данном случае центростремительной силой является сила кулоновского притяжения к ядру:  .
.
Согласно второму постулату Бора: 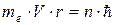 ,
,  где
где 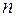 - главное квантовое число. Отсюда:
- главное квантовое число. Отсюда: 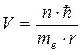
Подставим значение 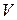 в выражение для центростремительной силы:
в выражение для центростремительной силы:
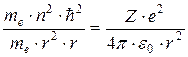 ,
,
тогда 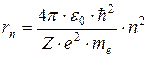 , где
, где 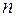 = 1,2,3,.… Следовательно, радиус орбиты электрона может принимать квантованные значения. Поэтому и радиус орбиты может принимать значения
= 1,2,3,.… Следовательно, радиус орбиты электрона может принимать квантованные значения. Поэтому и радиус орбиты может принимать значения 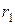 и
и 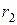 , а не
, а не  .
.
Для атома водорода радиус первой орбиты (Z=1, n=1):
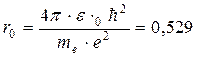 Å,
Å,
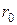 называют также боровским радиусом.
называют также боровским радиусом.
Внутренняя энергия атома слагается из кинетической энергии электрона (в первом приближении ядро считается неподвижным) и потенциальной энергии (энергии взаимодействия с ядром): 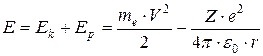 , т.к.
, т.к.  ,
,
то 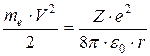 ,тогда:
,тогда:

Знак "-" связан с тем, что при 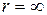 максимальная энергия системы равна нулю (связанная система), следовательно, приближаясь к ядру, получаем отрицательные значения. Это характерно для связанных систем, каковой является и атом водорода.
максимальная энергия системы равна нулю (связанная система), следовательно, приближаясь к ядру, получаем отрицательные значения. Это характерно для связанных систем, каковой является и атом водорода.
Подставим значение  :
:  (2.3)
(2.3)
Стационарное состояние с n = 1 называется основным (или невозбужденным) состоянием атома. Под действием внешних причин атом может перейти в состояние с большей энергией (n > 1) - это переход в возбужденное состояние. Таким образом, энергия атома оказывается квантованной, поскольку n принимает целочисленные значения.
Процесс излучения атомом энергии может быть показан графически, рис.17. Горизонтальные линии отвечают энергиям стационарных состояний для первых пяти значений n.
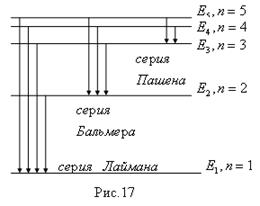 Расстояния между уровнями пропорциональны разностям энергий, освобождающихся при переходах электрона. При поглощении энергии направление стрелок обратное. По горизонтали не отложена никакая физическая величина, чертеж развернут для наглядности. По мере роста n разность энергий соседних состояний уменьшается, что приводит к сближению линий в спектре.
Расстояния между уровнями пропорциональны разностям энергий, освобождающихся при переходах электрона. При поглощении энергии направление стрелок обратное. По горизонтали не отложена никакая физическая величина, чертеж развернут для наглядности. По мере роста n разность энергий соседних состояний уменьшается, что приводит к сближению линий в спектре.
Если электрон удаляется из атома (n = ¥ ) с орбиты n = 1 происходит ионизация атома и должна совершаться работа: 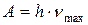 . Если эту работу выразить в эВ, то получим потенциал ионизации:
. Если эту работу выразить в эВ, то получим потенциал ионизации:
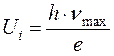
При переходе атома водорода (Z = 1) из состояния n в состояние m, по третьему постулату Бора получается фотон с энергией: 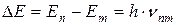
Распишем:
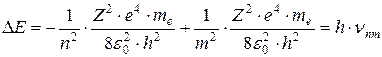 .
.
Отсюда (приняв для атома водорода Z=1):
 ,
,
в общем случае:
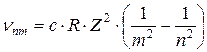
Если вычислить таким образом R, то ее величина совпадает с экспериментальными значениями постоянной Ридберга.
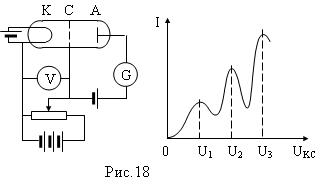
Опыты Франка и Герца
Франк и Герц проделали опыт с целью определения магнитного момента электрона. Схема опыта показана на рис.18. Трубка заполнена парами ртути. Электроны, вылетающие из катода К, ускорялись UКС , изменяемом потенциометром. Давление паров в трубке 1 мм рт ст. Между анодом и сеткой создавалось слабое электрическое поле UСА, равное -0,5В, тормозящее движение электронов. В опыте исследовалась зависимость силы тока I в цепи анода от UКС. Сила тока измерялась гальванометром G.
 На втором рисунке показана полученная зависимость
На втором рисунке показана полученная зависимость 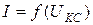 . Видно, что на кривой
. Видно, что на кривой 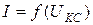 наблюдаются максимумы при UКС кратных 4,9 В. Вследствие дискретности энергетических уровней атомы могут поглощать энергию только порциями:
наблюдаются максимумы при UКС кратных 4,9 В. Вследствие дискретности энергетических уровней атомы могут поглощать энергию только порциями: 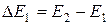 ;
; 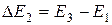 и т.д. Тогда можно рассмотреть три случая:
и т.д. Тогда можно рассмотреть три случая:
1. Если 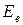 (энергия электрона) меньше
(энергия электрона) меньше  , то соударения упругие. Поскольку
, то соударения упругие. Поскольку 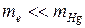 , то электрон не изменяет энергию при столкновениях и вид кривой I(UКС) имеет обычный вид - с ростом UКС растет I.
, то электрон не изменяет энергию при столкновениях и вид кривой I(UКС) имеет обычный вид - с ростом UКС растет I.
2. 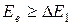 . Соударения перестают быть упругими. Электроны передают атомам ртути энергию DE1 и частично оседают на сетке. Поэтому наблюдается уменьшение IА.
. Соударения перестают быть упругими. Электроны передают атомам ртути энергию DE1 и частично оседают на сетке. Поэтому наблюдается уменьшение IА.
3. 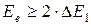 . Электрон может дважды испытать неупругое соударение. Тогда он теряет 2DE1. Поэтому глубина минимума в этом случае больше.
. Электрон может дважды испытать неупругое соударение. Тогда он теряет 2DE1. Поэтому глубина минимума в этом случае больше.
При достаточном разряжении ртути и соответствующей величине UКС электроны до соударения могут приобрести энергию, достаточную для перевода атома в состояние EКС. В этом случае на кривой наблюдается наличие максимумов, соответствующих второму потенциалу возбуждения (для ртути это 6,7В).
В опытах Франка и Герца, таким образом, непосредственно обнаруживается существование у атомов дискретных энергетических уровней.
Волны де Бройля
В курсе оптики было установлено наличие у световых волн корпускулярных свойств (эффект Комптона, фотоэффект). Естественно, возникает вопрос, не обладают ли, в свою очередь, материальные частицы и волновыми свойствами.
Для импульса фотона справедливы следующие соотношения:
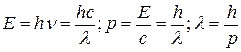
Де Бройль обобщил соотношение для импульса фотона, предположив, что оно имеет универсальный характер для любых волновых процессов, связанных с частицами, обладающих импульсом Р: 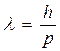 . Для частицы, движущейся со скоростью
. Для частицы, движущейся со скоростью 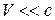 :
: 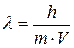
Если частица имеет кинетическую энергию 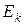 , то можно записать:
, то можно записать:
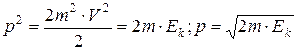
|
из
5.00
|
Обсуждение в статье: Модель атома водорода по Бору |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

