 |
Главная |
Мультиплетность спектров
|
из
5.00
|
Исследование спектров щелочных металлов при помощи приборов с большой разрешающей способностью показало, что каждая линия этих спектров является двойной (дублет). Например: Na - 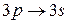 - две линии с длинами волн 5890 A и 5896 А.
- две линии с длинами волн 5890 A и 5896 А.
Структура спектра, отражающая расщепление линий на компоненты, называется тонкой структурой. Сложные линии, состоящие из нескольких компонент, получили название мультиплетов (дублеты, триплеты, квартеты и т.д.). В частном случае спектральные линии даже с учетом тонкой структуры могут быть одиночными (синглеты). Расщепление линий спектра, очевидно, обусловлено расщеплением энергетических уровней. Рассмотрим теперь на примере атома натрия как существование спина может объяснить мультиплетную структуру спектра.
Поскольку момент атомного остатка равен нулю, спины всех электронов полностью заполненных подоболочек, а также их орбитальные моменты компенсируют друг друга (L=0; S=0), момент атома Na равен моменту валентного электрона. (В дальнейшем будем обозначать квантовые числа, или их индексы, определяющие состояние электрона малыми буквами латинского алфавита - 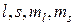 , для атома в целом – большими -
, для атома в целом – большими - 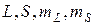 ). Момент же валентного электрона слагается из двух компонент
). Момент же валентного электрона слагается из двух компонент 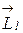 и
и 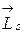 . Результирующая этих двух моментов дает полный импульс электрона. Сложение
. Результирующая этих двух моментов дает полный импульс электрона. Сложение 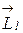 и
и 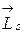 осуществляется по тем же законам, по которым складываются орбитальные моменты разных электронов. Т.е., момент импульса системы, состоящей из нескольких микрочастиц, равен сумме моментов отдельных частиц.
осуществляется по тем же законам, по которым складываются орбитальные моменты разных электронов. Т.е., момент импульса системы, состоящей из нескольких микрочастиц, равен сумме моментов отдельных частиц.
С механическими моментами связаны магнитные моменты, которые взаимодействуют друг с другом, подобно тому, как взаимодействуют два тока, или две магнитные стрелки. Это взаимодействие называется - спин - орбитальным взаимодействием. Для определения суммарного механического момента атома (или электрона в отдельности) введем новое квантовое число 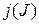 , определяющегося в случае электрона суммой его орбитального и спинового моментов. Основываясь на вышеизложенном, можно записать для суммарного момента атома натрия (его валентного электрона):
, определяющегося в случае электрона суммой его орбитального и спинового моментов. Основываясь на вышеизложенном, можно записать для суммарного момента атома натрия (его валентного электрона):
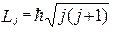
где 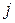 - квантовое число, имеющее значения:
- квантовое число, имеющее значения: 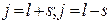 . При
. При 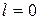 ,
, 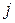 имеет одно значение:
имеет одно значение: 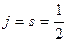 . Если
. Если 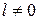 , то:
, то: 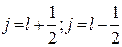 , которые соответствуют двум возможным ориентациям
, которые соответствуют двум возможным ориентациям 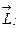 и
и 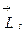 "параллельной" и "антипараллельной" (кавычки использованы, так как они никогда не бывают направлены вдоль одной прямой, и термины применены условно).
"параллельной" и "антипараллельной" (кавычки использованы, так как они никогда не бывают направлены вдоль одной прямой, и термины применены условно).
Энергия спин-орбитального взаимодействия зависит от взаимной ориентации орбитального и собственного моментов. Следовательно, состояния с различными 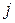 должны обладать различной энергией.
должны обладать различной энергией.
Таким образом, каждый энергетический терм (энергетическое состояние с соответствующим значением L, обозначаемое большой буквой латинского алфавита) ряда Р (L=1) расщепляется на два, соответствующих 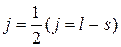 и
и 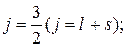 D(L=2) на термы с
D(L=2) на термы с 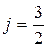 и
и 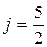 и т.д. Каждому терму ряда S (L=0) соответствует только одно значение
и т.д. Каждому терму ряда S (L=0) соответствует только одно значение 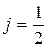 , поэтому термы ряда S не расщепляются.
, поэтому термы ряда S не расщепляются.
Термы принято обозначать символически 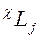 , следовательно, можно записать, например, для
, следовательно, можно записать, например, для 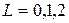 :
:
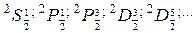
Верхний левый c - мультиплетность термов, определяемая количеством ориентаций спинового момента, т.е. 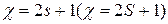 .
.
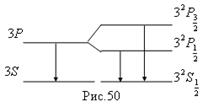 Хотя ряд S синглетный, но c=2 также ставится, чтобы показать, что этот ряд принадлежит к системе термов в целом дублетной. Для квантового числа j также существует правило отбора: D j = 0; ± 1. Исходя из вышесказанного, можно показать, каким образом возникает желтый дублет в спектре атома натрия, рис.50.
Хотя ряд S синглетный, но c=2 также ставится, чтобы показать, что этот ряд принадлежит к системе термов в целом дублетной. Для квантового числа j также существует правило отбора: D j = 0; ± 1. Исходя из вышесказанного, можно показать, каким образом возникает желтый дублет в спектре атома натрия, рис.50.
|
из
5.00
|
Обсуждение в статье: Мультиплетность спектров |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

