 |
Главная |
Понятие о химической связи и валентности
|
из
5.00
|
Молекула - наименьшая частица вещества, состоящая из одинаковых или различных атомов, соединенных между собой химическими связями и, являющаяся носителем его основных химических и физических свойств. Химические связи обусловлены взаимодействием внешних валентных электронов. Наиболее часто в молекулах встречаются два типа связи - ионная и ковалентная.
1. Ионная (гетерополярная). Электроны в молекуле можно разделить на две группы, каждая из которых все время находится около одного из ядер. Электроны распределяются так, что около одного из ядер образуется избыток электронов, а у другого их недостаток. Т.е. молекула состоит из двух ионов противоположных знаков, притягивающихся друг к другу (NaCl; KBr и т.д.)
2. Ковалентная (гомеополярная). Часть ионов движется около обоих ядер. Эта связь образуется парами электронов с противоположно направленными спинами (H2; CN; N2; O2 и т.д.).
В молекуле первого рода электроны распределены симметрично, второго рода обладают некоторой асимметрией в распределении электронов, благодаря которой молекулы имеют электрический дипольный момент. Классические частицы обладают индивидуальностью (положение в пространстве, импульс). Все электроны, как мы уже отмечали, имеют одинаковые физические свойства - массу, заряд, спин и т.д., то есть являются тождественными.
Свойства системы одинаковых тождественных частиц проявляются в фундаментальном принципе квантовой механики - принципенеразличимости тождественных частиц. В квантовой механике для микрочастиц возможно лишь определить вероятность 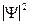 нахождения частицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то можно говорить лишь о вероятности нахождения в данной области одной из тождественных частиц. Т.о. в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми. Ковалентная связь объясняется на основе принципа неразличимости тождественных частиц, например электронов в молекуле водорода. Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным взаимодействием. Это взаимодействие можно объяснить тем, что электрон каждого из атомов молекулы проводит некоторое время у ядра другого атома и, следовательно, осуществляется связь обоих атомов, образующих молекулу. При сближении двух водородных атомов до расстояния порядка боровского радиуса возникает их взаимное притяжение и образуется устойчивая молекула водорода, рис.57.
нахождения частицы в окрестностях той или иной точки пространства. Если же волновые функции двух тождественных частиц в пространстве перекрываются, то можно говорить лишь о вероятности нахождения в данной области одной из тождественных частиц. Т.о. в квантовой механике тождественные частицы полностью теряют свою индивидуальность и становятся неразличимыми. Ковалентная связь объясняется на основе принципа неразличимости тождественных частиц, например электронов в молекуле водорода. Неразличимость частиц приводит к специфическому взаимодействию между ними, называемому обменным взаимодействием. Это взаимодействие можно объяснить тем, что электрон каждого из атомов молекулы проводит некоторое время у ядра другого атома и, следовательно, осуществляется связь обоих атомов, образующих молекулу. При сближении двух водородных атомов до расстояния порядка боровского радиуса возникает их взаимное притяжение и образуется устойчивая молекула водорода, рис.57.
 Молекула водорода является квантовой системой, она описывается уравнением Шредингера, учитывающим движение электрона в молекуле, колебание атомов в молекуле, вращение молекулы. Решение этого уравнения - очень сложная задача, которая обычно разбивается на две: для электронов и ядер. Энергия молекулы определяется:
Молекула водорода является квантовой системой, она описывается уравнением Шредингера, учитывающим движение электрона в молекуле, колебание атомов в молекуле, вращение молекулы. Решение этого уравнения - очень сложная задача, которая обычно разбивается на две: для электронов и ядер. Энергия молекулы определяется:  , где члены этого выражения определяют:
, где члены этого выражения определяют:
· энергию движения электронов относительно ядер;
· энергию колебания ядер (в результате которого периодически изменяется относительное положение ядер);
· энергию вращения ядер (в результате которого периодически изменяется ориентация молекулы в пространстве). Величины этих энергий относятся: 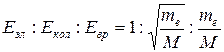 , где
, где  масса электрона, M - порядок массы ядер атомов в молекуле. Отсюда:
масса электрона, M - порядок массы ядер атомов в молекуле. Отсюда:  .
.
Каждая из энергий квантуется, ей соответствует набор дискретных уровней энергии. Из теории и эксперимента следует, что расстояние между вращательными уровнями энергии гораздо меньше чем между колебательными. А расстояние между колебательными уровнями гораздо меньше, чем между электронными.
Что касается валентности, то ее можно определить следующим образом: Валентность - это способность атома отдавать или приобретать часть электронов внешних электронных оболочек (валентных электронов). В случае ионной связи - это число отданных или присоединенных атомом электронов. В случае ковалентной связи валентность равна числу обобществленных электронов.
Молекулярные спектры
 Свойства энергетических уровней молекул проявляется в молекулярных спектрах - спектрах, возникающих при квантовых переходах между уровнями энергии молекул, рис.58. Спектр излучения молекулы определяется структурой ее энергетических уровней и соответствующими правилами отбора. Изменение квантовых чисел, соответствующих колебательному и вращательному движению должно равняться единице со знаком плюс или минус. При разных типах переходов между уровнями возникают различные типы молекулярных спектров. Частоты спектральных линий, испускаемых молекулами, могут соответствовать переходам с одного электронного уровня на другой - электронные спектры, или с одного колебательного (вращательного) уровня на другой - колебательные (вращательные) спектры. Кроме того, возможны и переходы между различного типа уровнями, в результате чего возникают электронно-колебательные и колебательно-вращательные спектры.
Свойства энергетических уровней молекул проявляется в молекулярных спектрах - спектрах, возникающих при квантовых переходах между уровнями энергии молекул, рис.58. Спектр излучения молекулы определяется структурой ее энергетических уровней и соответствующими правилами отбора. Изменение квантовых чисел, соответствующих колебательному и вращательному движению должно равняться единице со знаком плюс или минус. При разных типах переходов между уровнями возникают различные типы молекулярных спектров. Частоты спектральных линий, испускаемых молекулами, могут соответствовать переходам с одного электронного уровня на другой - электронные спектры, или с одного колебательного (вращательного) уровня на другой - колебательные (вращательные) спектры. Кроме того, возможны и переходы между различного типа уровнями, в результате чего возникают электронно-колебательные и колебательно-вращательные спектры.
Типичные молекулярные спектры - полосатые, представляющие собой совокупность более или менее узких полос в ультрафиолетовой, видимой и ИК-областях. Если применять спектральные приборы высокой разрешающей способности, то можно видеть, что полосы представляют собой настолько тесно расположенные линии, что они с трудом разрешаются. Структура молекулярных спектров различна для различных молекул и с увеличением числа атомов в молекуле усложняется. Колебательными и вращательными спектрами обладают только многоатомные молекулы, двухатомные их не имеют. Это объясняется тем, что в двухатомных молекулах не наблюдается изменения дипольных моментов (при колебательных и вращательных переходах отсутствует изменение дипольного момента, что является необходимым условием отличности от нуля вероятности перехода).
|
из
5.00
|
Обсуждение в статье: Понятие о химической связи и валентности |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

