 |
Главная |
Уравнение Ван-дер-Ваальса
|
из
5.00
|
Поведение газов, которые близки к конденсации, не описывается уравнением состояния идеального газа. Однако это уравнение можно усовершенствовать так, чтобы оно приближенно описывало не только свойства газа, но и свойства жидкости. Такое уравнение было получено в 1873 г. Ван-дер-Ваальсом. При выводе уравнения учитывались конечные размеры молекул и силы взаимодействия между ними. Уравнение Ван-дер-Ваальса нашло широкое применение, поскольку, с одной стороны, оно является довольно простым, а с другой – удовлетворительно описывает поведение многих веществ в широких интервалах температур и давлений. Для одного моля вещества уравнение имеет вид:
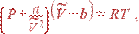
| (1) |
где a и b - константы, зависящие от свойств вещества. При a = b = 0 уравнение (1) превращается в уравнение состояния идеального газа. Член  описывает уменьшение давления газа вследствие притяжения молекул друг к другу, а член b представляет собой объем самих молекул. Изотермы, соответствующие уравнению (1), приведены на рис. 2.3.
описывает уменьшение давления газа вследствие притяжения молекул друг к другу, а член b представляет собой объем самих молекул. Изотермы, соответствующие уравнению (1), приведены на рис. 2.3.
 
|
Они имеют много общего с изотермами рисунка 2.2. В обоих случаях на одной из изотерм имеется горизонтальная точка перегиба K, называемая критической точкой. При T>Tk изотермы имеют похожий вид. Однако при T<Tk их вид различен. В то время как опытные изотермы на рис. 2.2 имеют горизонтальный участок с изломами на концах, изотермы Ван-дер-Ваальса представляют собой немонотонные кривые с максимумом и минимумом. Причина столь различного поведения состоит в том, что горизонтальные участки изотерм в области жидкость – пар не соответствуют гомогенному состоянию вещества, поскольку в этой области оно разделяется на жидкую и парообразную фазы. Если ненасыщенный пар изотермически сжимать до давления насыщения, а затем дальше, то происходит конденсация пара, не сопровождающаяся ростом давления. Этому и соответствует горизонтальный участок изотермы. Однако, если пар тщательно очищен от пыли и электрических зарядов, то можно избежать конденсации и достичь давления, значительно более высокого, чем давление насыщенного пара. Такой пар называется пересыщенным или переохлажденным. Это состояние является метастабильным. В результате легкого возмущения оно может перейти в устойчивое состояние, характеризуемое наличием жидкой и парообразной фаз. Такие гомогенные состояния пересыщенного пара описываются участком ef изотермы Ван-дер-Ваальса на рис. 2.4. Участок bc изотермы описывает гомогенные состояния перегретой жидкости, которые также являются метастабильными. Участок же ce соответствует нестабильным состояниям вещества, которые характеризуются противоестественным уменьшением давления при сжатии и в эксперименте не реализуются.. По изотерме Ван-дер-Ваальса можно определить положение горизонтального участка, описывающего состояние системы жидкость-пар при данной температуре, т.е. давление насыщенного пара Pнас(T). Горизонтальный участок bdf располагается так, что площади обеих частей "восьмерки" bcdefdb являются равными. Доказательство этого имеется, например, в книге Э. Ферми "Термодинамика".
|
из
5.00
|
Обсуждение в статье: Уравнение Ван-дер-Ваальса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

