 |
Главная |
РН И БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА
|
из
5.00
|
Буферные системы крови и клеток предназначены для поддержания постоянства рН среды в условиях образования (или поступления) в организме избыточных количеств кислых продуктов или их избыточного выделения. В первом случае это касается ацидоза, во втором - алкалоза.
Буферные системы в общем виде могут быть построены по двум принципам:
а) слабой кислоты и ее соли с сильным основанием, где числитель представляет собой основание, а знаменатель - кислоту;
б) слабого основания и его соли с сильной кислотой, где в числителе - кислотная часть, а в знаменателе - основная.
Основными буферными системами оранизма являются:
Н2СО3
1) Бикарбонатная NаНСО3
NаН2РО4
2) Фосфатная Nа2НРО4
3) белковая 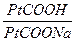
4) гемоглобиновая 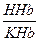
 Принцип действия таких систем аналогичен, поэтому разберем его на примере самой мощной буферной системы крови - бикарбонатной.
Принцип действия таких систем аналогичен, поэтому разберем его на примере самой мощной буферной системы крови - бикарбонатной.
Чаще всего в организме возникают ситуации, когда в результате заболеваний, физической нагрузки, недостатка кислорода, интоксикаций в тканях накапливаются кислые метаболиты (молочная кислота, кетоновые тела). В этом случае происходит реакция взаимодействия этих кислот с основанием бикарбонатной системы:
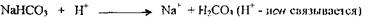
Однако, образующаяся угольная кислота не является стойкой и в легких распадается на СО2 и Н2О, которые и выделяются. В итоге рН крови не меняется, и единственное, что происходит - это уменьшение концентрации буферных оснований (именно концентрацию бикарбоната часто определяют в лабораторной практике для установления наличия ацидоза). При сдвиге рН крови в щелочную сторону реакция основных эквивалентов происходит с кислотной частью бикарбонатной буферной системы, т.е.
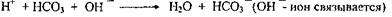
В этой ситуации защелачивания среды не происходит, т.к. слабая кислота Н2СОз возмещает ушедший на образование Н2О протон путем диссоциации:
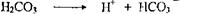
Буферные системы фосфатная и аммонийная действуют по такому же принципу.
Буферные систмы в организме работают сопряженно. Сопряженное действие бикарбонатной и гемоглобиновой буферных ситем отражают следующие реакции:
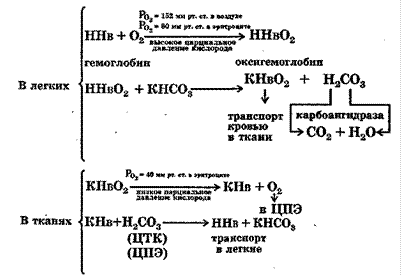
Буферные растворы широко используются в лабораторной практике. Наиболее употребительными являются: фосфатный буфер, аммонийный буфер, tris - НС1 - буфер, цитратный буфер и др.
Для проведения анализов их приходится готовить по прописям, содержащимся в описании методик, или в справочниках. Если нет описания, любую буферную смесь можно приготовить, используя формулу: 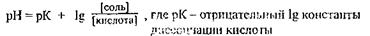
Предположим, что К дисс. кислоты – 10 -5, а отношение [соли] к [кислоте] -10, тогда рН смеси = 5 + 1 = 6,0.
Обратной операцией можно рассчитать соотношение количеств соли и кислоты для заданного значения рН смеси. Концентрация буферных растворов выражается в молях/л. Чем выше молярность буфера, тем выше его буферная емкость (количество г-эквивалентов кислоты или щелочи, которое нужно добавить в смесь, чтобы изменить рН на 1 единицу). Принятое обозначение на склянке с буферным раствором, выглядит следующим образом: 0,2 М фосфатный буфер рН 7,4.
|
из
5.00
|
Обсуждение в статье: РН И БУФЕРНЫЕ СИСТЕМЫ ОРГАНИЗМА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

