 |
Главная |
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Примеры решения задач
|
из
5.00
|
Примеры решения задач
Тепловым эффектом химической реакцииназываетсяизменение энергии системы при протекании в ней химической реакции при условии, что система не совершает никакого другого работы, кроме работы расширение.
Если в результате реакции теплота выделяется, т.е. энтальпия реакции понижается (D Н< 0),то реакция называется экзотермической. Реакция, протекающая с поглощением теплоты, т.е. с повышением энтальпии (D Н> 0), называется эндотермической.
Тепловые эффекты реакции рассчитывают по следствию из закона Гесса на основании стандартных теплот образования энтальпий веществ – D Н0 298 образования вещества. Стандартные теплоты образования простых веществ равны нулю.
Следствие из закона Гесса: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, взятых с учетом их стехиометрических коэффициентов.
По следствию из закона Гесса можно рассчитывать и другие термодинамические функции: энтальпию, энтропию, энергию Гиббса.



Критерием самопроизвольного протекания процесса является изобарно–изотермический потенциал или энергия Гиббса, которую можно рассчитать по формуле (через энтальпию и энтропию):

В изобарно–изотермических условиях самопроизвольно протекают процессы с уменьшением энергии Гиббса:
D G<0.
Состояния равновесия  системы достигается при D G = 0, т.е.
системы достигается при D G = 0, т.е.
0 = DН–Т D S. Из этого уравнения можно найти температуру, при которой наступает состояния равновесия:

Все стандартные значения термодинамических функций приведены в справочных таблицах 1, 2, 3.
Пример 1.
Вычислите тепловой эффект реакции :
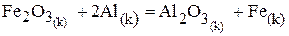
при 298 К и постоянная давлении.
На основании следствия из закона Гесса и табличных данных стандартных энтальпий  и
и  учитывая, что энтальпия простых веществ (Al и Fe) равны нулю, составляем уравнение:
учитывая, что энтальпия простых веществ (Al и Fe) равны нулю, составляем уравнение:


Данная реакция является экзотермическая, так как  < 0, т.е. протекает с выделением тепла.
< 0, т.е. протекает с выделением тепла.
Пример 2.
Вычислите изменения энтропии в газообразной системе в результате протекания реакции CH4(г)+H2O = CO(г)+ 3H2(г) при 298 К и постоянном давлении.
По следствию из закона Гесса можно записать:

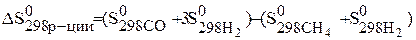
Значения стандартных энтропий находим в таблице и подставляем в уравнение и рассчитываем энтропию реакцию:
 = (197,54+ 3×130,58)–(186,19+188,7)= 214,39 Дж/к × моль.
= (197,54+ 3×130,58)–(186,19+188,7)= 214,39 Дж/к × моль.
Пример 3.
Определите температуру Т, при которой установится равновесие реакции 
Определяем величины изменения энтальпии и энтропии реакции:
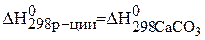 –
– 
 ,
,
 ;
;


В состоянии равновесия  .
.
Тогда температура будет равна:
 .
.
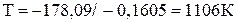 .
.
Пример 4.
В каком направлении при стандартных условиях может самопроизвольно протекать реакция 3 SO2 (г) « S(ромб) + 2SO3 (г)?
Изменение энергии Гиббса реакции определяют по уравнению:

Температура Т – абсолютная температура (для стандартных условий Т=298 К). Энтальпию и энтропию реакции рассчитывают по следствию из закона Гесса: 



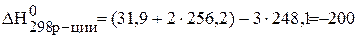 Дж/моль×К=0,200кДж/моль×К.
Дж/моль×К=0,200кДж/моль×К.
Рассчитываем энергию Гиббса реакции:
 кДж/моль.
кДж/моль.
Так как  > 0,то данная реакция самопроизвольно может протекать в обратном направлении.
> 0,то данная реакция самопроизвольно может протекать в обратном направлении.
Пример 5.
Возможно, ли самопроизвольно протекание реакции 
Записываем энергию Гиббса по следствию из закона Гесса:

 –
– 
Подставляем конкретные значения в уравнения с учетом, что энергия Гиббса простых веществ равны нулю.

 .
.
Так как –  < 0, то самопроизвольное протекание данной реакции возможно.
< 0, то самопроизвольное протекание данной реакции возможно.
Контрольные задания
41*. Исходя из теплоты образования H2O(ж) и теплового эффекта реакции при стандартных условиях
Н2O2(ж) = H2O(ж) + 1/2 O2(г) ; H = 97,9 кДж,
вычислите  перекиси водорода Н2О2.
перекиси водорода Н2О2.
Таблица 1. Стандартные теплоты (энтальпии) образования  некоторых веществ
некоторых веществ
| Вещест- во | Состояние |  ,
кДж/моль ,
кДж/моль
| Вещест- во | Состояние |  ,
кДж/моль ,
кДж/моль
| |
| Al2O3 | к (кристалли-ческое) | CaO | к | 635,1 | ||
| CO | г (газообразное) | 110,5 | CaCO3 | к | ||
| CO2 | г | 396,3 | FeO | к | 263,7 | |
| CH4 | г | 74,85 | H2O | ж (жидкое) | 285,84 | |
| С2H2 | г | 226,75 | H2O | г | 241,84 | |
| С2H6 | г | 84,67 | H2S | г | 20,15 | |
| СS2 | г | 115,3 | MgO | к | 601,2 | |
| SO2 | г | 296,9 | Fe2O3 | к | 821,3 |
42*. При сгорании газообразного этана С2Н6образуются CO2(г) и Н2О(ж). Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект.
43*. Сожжены с образованием Н2О(г) равные объемы водорода и ацетилена С2Н2, взятые при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз?
44*. Вычислите тепловой эффект реакции при стандартных условиях 2Mg(к)+ CO2(г) = 2MgO(к)+ C(графит).
45*. Вычислите тепловой эффект реакции восстановления оксида цинка углем с образованием СО, если теплота образования ZnO(к) при стандартных условиях равна 348 кДж/моль.
46*. Исходя из теплоты образования газообразного диоксида углерода (  = 396,3 кДж/моль) и термохимического уравнения
= 396,3 кДж/моль) и термохимического уравнения
C(графит) + 2N2О(г) = CO2(г) + 2N2(г) ; Н = 557,5 кДж
вычислите теплоту образования N2O(г).
47*. При взаимодействии газообразных метана СН4и сероводорода Н2S образуются сероуглерод СS2(г) и водород. Напишите термохимическое уравнение этой реакции и вычислите ее тепловой эффект при стандартных условиях.
48*. Исходя из уравнения реакции
СН3ОН(ж) + 3/2 О2(г) = CO2(г) + 2H2O(ж); Н= 726,5 кДж
вычислите стандартную теплоту образования метилового спирта СН3ОН(ж).
49. Исходя из реакции
SiO2+ 2Mg = 2MgO + Si; Н= 372 кДж
вычислите стандартную теплоту образования SiO2(к), если стандартная теплота образования MgO(к) равна 601,2 кДж/моль.
50*. Вычислите теплоту образования СаС2(к) исходя из стандартных теплот образования СаО(к) и СО(г) и стандартного теплового эффекта реакции СаО(к) + 3С(к) = СаС2(к) + СО(г) ; Н = 460 кДж.
51*. Восстановление Fe2O3 водородом протекает по уравнению
Fe2O3(к) + 3Н2(г) = Fe(к) + 3Н2О(г) ; Н= 96,61 кДж.
Возможна ли эта реакция при стандартных условиях, если изменение энтропии S = 0,1387 кДж/(мольК)?
52**.Рассчитайте значение  реакции
реакции
Pb(к) + CuO(к) = PbO(к) + Cu(к)
и установите, в каком направлении она может протекать самопроизвольно при стандартных условиях.
53**. Укажите, какая из двух реакций будет протекать самопроиз-вольно при стандартных условиях:
Fe(к) + Al2O3(к) = Al(к) + Fe2O3(к);
Al(к) + Fe2O3(к) = Fe(к) + Al2O3(к).
Ответ подтвердите расчетом.
54**. Установите возможность (или невозможность) самопроиз- вольного протекания реакции
CuO(к) + Н2(г) = Cu(к) + H2O(ж)
при стандартных условиях. Ответ подтвердите расчетом.
Таблица 2. Стандартные энергии Гиббса образования  некоторых веществ
некоторых веществ
| Вещество | Состояние |  ,
кДж/моль ,
кДж/моль
| Вещество | Состояние |  ,
кДж/моль ,
кДж/моль
| |
| Al2O3 | к | –1580 | Fe2O3 | к | –741,5 | |
| BaCO3 | к | –528,4 | H2O | ж | –237,2 | |
| BaO | к | –1139 | H2O | г | –228,4 | |
| CO2 | г | –394,4 | NH3 | г | –16,7 | |
| CuO | к | –127,0 | NO2 | г | –51,8 | |
| H2S | г | –33,3 | PbO | к | –188,5 | |
| SO2 | г | –300,4 | FeO | к | –244,3 |
55**. Определите возможность или невозможность самопроизвольного протекания реакции
4NН3(г) + 5О2(г) = 4NО2(г) + 6H2O(г)
при стандартных условиях. Ответ подтвердите расчетом.
56**. Определите, какая из реакций
BaO(к) + CO2(г) = BaCO3(к);
BaCO3(к) = BaO(к) + CO2(г)
термодинамически возможна при стандартных условиях. Ответ подтвердите расчетом.
57. На основании стандартных теплот образования * и стандартных энтропий соответствующих веществ *** вычислите  реакции, протекающей по уравнению
реакции, протекающей по уравнению
CO(г) + H2O(ж) = CO2(г) + H2(г).
58. Вычислите  для реакции
для реакции
СаСО3(к) = СаО(к) + CO2(г)
при 25, 500 и 1500 С. Зависимостью  * и
* и  *** от температуры пренебречь. Сделайте вывод о возможности протекания реакции при указанных температурах.
*** от температуры пренебречь. Сделайте вывод о возможности протекания реакции при указанных температурах.
Таблица 3. Стандартные абсолютные энтропии  некоторых веществ
некоторых веществ
| Вещество | Состоя-ние |  ,
Дж/(моль·К) ,
Дж/(моль·К)
| Вещество | Состоя-ние |  ,
Дж/(моль·К) ,
Дж/(моль·К)
| |
| CO | г | 197,4 | CaCO3 | к | 92,90 | |
| CO2 | г | 213,6 | H2 | г | 130,6 | |
| CaO | к | 39,70 | H2O | ж | 70,1 |
59*. Вычислите  реакции и определите принципиальную возможность или невозможность осуществления при стандартных условиях реакции
реакции и определите принципиальную возможность или невозможность осуществления при стандартных условиях реакции
SO2(г) + 2H2S(г) = 3S(к) + 2H2O(ж).
60*. Можно ли оксид железа FeO восстановить алюминием при стандартных условиях? Ответ подтвердите расчетом.
ХИМИЧЕСКАЯ КИНЕТИКА
Примеры решения задач
Химическая кинетика изучает скорости химических реакций и механизмы их протекания, а также факторы, влияющие на них.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице объема реакционного пространства:
 ,
,
где D С – изменение молярного концентрации, D t – промежуток времени.
Единицы измерения скорости (моль/л × с).
Скорость химической реакции зависит от природы реагирующих веществ, концентрации реагентов, температуры, давления, присутствия катализатора.
|
из
5.00
|
Обсуждение в статье: ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. Примеры решения задач |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

