 |
Главная |
Контрольная работа №3
|
из
5.00
|
Вариант№1
1. Дайте определение катализа?
2.Конверсию монооксида углерода водяным паром проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*P*(ZCO-ZCO2*ZH2/(ZH2O*Kp) (мольСО/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=(9000/22,4)*exp((40000/8,31)*(1/498-1/T))
Зависимость константы равновесия от температуры:
lgKp=2485.5/T + 1.565∙lg(T) – 0.066∙10-3∙Т – 0.207∙105/Т2 - 6.946
Рассчитать объём реактора, необходимого для достижения степени превращения монооксида углерода ХСО=0,7 и производительность по водороду, если исходный состав (мольные доли): монооксид углерода 0,15, водяной пар 0,5, водород 0,1, диоксид углерода 0,05, остальное – азот; расход смеси 10000 м3/ч, температура смеси на входе в реактор 700 К, давление 0,1 МПа.
3.Как получают исходное сырье: азот и водород, для синтеза аммиака?
Вариант№2
1.Роль катализа в химической промышленности.
2.Разложение метанола проводят в адиабатическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*P*((ZCH3OH/ZCO)0,25*Kp0,5-ZH2*(ZCO/ ZCH3OH)0,25)
(моль CH3OH/м3*)
Зависимость константы скорости прямой реакции от температуры:
K+=0,041*exp(440000/(8,31*573)-44000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=-3886/T+8,142*lg(T)-2,47*10-3*T+0,27*10-6*Т2+0,014*105/T2-10,826
Рассчитать объём реактора, необходимого для достижения степени превращения метанола ХСН3ОН=0,6 и производительность по водороду, если исходный состав (мольные доли): метанол 0,3, монооксид углерода 0,01, водород 0,01, остальное – водяной пар, расход смеси 8000 м3/ч, температура смеси на входе в реактор 1000 К, давление 0,1 МПа
3.Обоснуйте выбор давления для синтеза аммиака.
Вариант№3
1.Какие специфические свойства имеет катализатор?
2.Дегидрирование бутана проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*(PC4H10/PC4H8)*(1-P C4H8*PH2/( PC4H10*Kp)) (м3С4H10/м3*с)
Зависимость константы скорости прямой реакции от температуры:
Lg(K+)=9,6-9050/T
Зависимость константы равновесия от температуры:
lgKp=-6700/T +7.574
Рассчитать объём реактора, необходимого для достижения степени превращения бутана ХС4Н10=0,75 и производительность по бутену, если исходный состав (мольные доли): бутан 0,32, бутен 0,02, водород 0,01, остальное – азот, расход смеси 15000 м3/ч, температура смеси на входе в реактор 1200 К, давление 0,1 МПа
3.Обоснуйте выбор температурного режима синтеза аммиака.
Вариант№4
1. Что такое селективный катализ?
2.Дегидрирование этилбензола проводят в адиабатическом реакторе полного смешения..
C6H5-C2H5= C6H5-C2H3+H2
Кинетическое уравнение:
U=k+*(PC6H5C2H5-P C6H5C2H3*PH2/Kp)/(1+Kc*(PC6H5C2H3)2)
(моль C6H5C2H5/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=exp(31,303-192740/(8,31*T))
Зависимость константы равновесия от температуры:
Kp=exp(-13,069-13127/T-3,077*10-3*T+3,6*10-7*T2+4,28*ln(T)) Зависимость константы адсорбционного равновесия от температуры:
Kc=exp(58241/(8,31*T)-3,8258)
Рассчитать объём реактора, необходимого для достижения степени превращения этилбензола ХС6Н5С2Н5=0,65 и производительность по стиролу, если исходный состав (мольные доли): этилбензол 0,21, остальное – водяной пар, расход смеси 5000 м3/ч, температура смеси на входе в реактор 900 К, давление 0,1 МПа.
3.Какие методы выделения аммиака из циркуляционного газа применяют в установках среднего давления?
Вариант№5
1.Роль катализа в производстве серной кислоты.
2.Синтез метанола проводят в адиабатическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*(P*(ZH2*(ZCO/ZCH3OH)0,25-(ZCH3OH/ZCO)0,25/Kp0,5)
(моль СО/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=0,045*exp(44000/(8,31*633)-44000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=3148/T – 9.2833∙lg(T) + 3.145∙10-3∙Т – 4.2613∙10-7∙Т2 + 13.8144
Рассчитать объём реактора, необходимого для достижения степени превращения монооксида углерода ХСО=0,5 и производительность по метанолу, если
исходный состав (мольные доли): монооксид углерода 0,21, водород 0,57, метанол 0,01, остальное – метан, расход смеси 50000 м3/ч, температура смеси на входе в реактор 550 К, давление 25 МПа.
3.Обосновать использование циркуляционной схемы в синтезе метанола.
Вариант№6
1.Роль катализа в производстве минеральных удобрений.
2.Разложение аммиака проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=(k+/P)*((PNH3/PH21,5)0,25-PN2*PH21,5/ (PNH3*Kp))
(моль NH3/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=18,56*1015*exp(-142630/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=-2078/T+ 2.4943∙lg(T)+ 1.256∙10-4∙Т- 1.8564∙10-7∙Т2 - 2.206.
Рассчитать объём реактора, необходимого для достижения степени превращения аммиака ХNH3=0,8 и производительность по водороду, если исходный состав (мольные доли): аммиак 0,27, азот 0,01, водород 0,01, остальное – метан, расход смеси 6000 м3/ч, температура смеси на входе в реактор 1000 К, давление 0,1 МПа.
3.Обоснуйте оптимальные условия синтеза аммиака.
Вариант№7
1.Роль катализа в нефтепереработке.
2.Окисление диоксида серы проводят в адиабатическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*PO2*PSO2/(PSO2+0,8*PSO3)*(1-PSO32/(PSO22*PO2*Kp2))
(моль SO2/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=52*exp(37000/(8,31*813)-37000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=4905/T -4.6455
Рассчитать объём реактора, необходимого для достижения степени превращения диоксида серы ХSO2=0,7 и производительность по триоксиду серы, если исходный состав (мольные доли): диоксид серы 0,12, триоксид серы – 0,01, остальное – воздух, расход смеси 60000 м3/ч, температура смеси на входе в реактор 650 К, давление 0,1 МПа.
3.Проанализируйте влияние температуры и давления на выход аммиака.
Вариант№8
1.Роль катализа в получении синтез-газа.
2.Дегидрирование бензола проводят в адиабатическом реакторе полного смешения.
2С6Н6=C12H10+H2
Кинетическое уравнение:
U=k+*PC6H62- k-*PC12H10*PH2 (моль C6H6/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=2,16*1015*exp(-118000/(8,31*T))
Зависимость константы скорости обратной реакции от температуры:
K-=1,35*108*exp(-46000/(8,31*T))
Рассчитать объём реактора, необходимого для достижения степени превращения бензола Х C6H6=0,7 и производительность по дифенилу, если исходный состав (мольные доли): бензол 0,25, остальное – водяной пар, расход смеси 12000 м3/ч, температура смеси на входе в реактор 950 К, давление 0,1 МПа.
3.Обоснуйте с позиций термодинамики и кинетики параметры синтеза метанола.
Вариант№9
1.Роль катализа в очистке синтез-газа от кислородсодержащих соединений.
2.Синтез аммиака проводят в адиабатическом реакторе полного смешения..
Кинетическое уравнение:
U=(k+/P)*(PN2*PH21,5/ PNH3-) (PNH3/PH21,5)/Кр) (моль NН3/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=205/3,6*exp(59000/(8,31*773)-59000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=2078/T- 2.4943∙lg(T)- 1.256∙10-4∙Т+ 1.8564∙10-7∙Т2 + 2.206.
Рассчитать объём реактора, необходимого для достижения степени превращения азота Х N2=0,5 и производительность по аммиаку, если исходный состав (мольные доли):, азот 0,21, водород 0,63, аммиак 0,04, остальное – метан, расход смеси 45000 м3/ч, температура смеси на входе в реактор 650 К, давление 25 МПа.
3.Энергетическая подсистема ХТС.
Вариант№10
1. Роль катализа в защите окружающей среды.
2.Конверсию метана водяным паром проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*РCH4*PH2O-PCO*PH23/Kp (моль СН4 /м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=(exp(38,02-11994/T))/T3
Зависимость константы равновесия от температуры:
lgKp=8.64 - 9871/T+7.14/lgT + 1.88∙10-3∙Т – 9.4∙10-7∙Т2
Рассчитать объём реактора, необходимого для достижения степени превращения метана ХСН4=0,9 и производительность по водороду, если исходный состав (мольные доли): метан 0,2, водяной пар 0,75, остальное – азот, расход смеси 35000 м3/ч, температура смеси на входе в реактор 1100 К, давление 1 МПа.
3.Особенности синтеза метанола при низком давлении.
Вариант№11
1.Где может быть использован теплоноситель, получаемый при сжигании топлива?
2.Конверсию монооксида углерода водяным паром проводят в изотермическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*P*(ZCO-ZCO2*ZH2/(ZH2O*Kp) (мольСО/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=(9000/22,4)*exp((40000/8,31)*(1/498-1/T))
Зависимость константы равновесия от температуры:
lgKp=2485.5/T + 1.565∙lg(T) – 0.066∙10-3∙Т – 0.207∙105/Т2 - 6.946
Рассчитать объём реактора, необходимого для достижения степени превращения монооксида углерода ХСО=0,7 и производительность по водороду, если исходный состав (мольные доли): монооксид углерода 0,15, водяной пар 0,5, водород 0,1, диоксид углерода 0,05, остальное – азот; расход смеси 10000 м3/ч, температура в реакторе 800 К, давление 0,2 МПа.
3.Обоснуйте с позиций термодинамики и кинетики параметры синтеза аммиака.
Вариант№12
1. Какие катализаторы используются при получении азотных соединений и удобрений?
2.Разложение метанола проводят в изотермическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*P*((ZCH3OH/ZCO)0,25*Kp0,5-ZH2*(ZCO/ ZCH3OH)0,25)
Зависимость константы скорости прямой реакции от температуры:
K+=0,041*exp(440000/(8,31*573)-44000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=-3886/T+8,142*lg(T)-2,47*10-3*T+0,27*10-6*Т2+0,014*105/T2-10,826
Рассчитать объём реактора, необходимого для достижения степени превращения метанола ХСН3ОН=0,6 и производительность по водороду, если исходный состав (мольные доли): метанол 0,25, монооксид углерода 0,01, водород 0,01, остальное – водяной пар, расход смеси 8500 м3/ч, температура в реактор 950 К, давление 0,15 МПа.
3.Проанализируйте влияние температуры и давления на выход аммиака.
Вариант№13
1. Какие катализаторы используются в нефтепереработке?
2.Дегидрирование бутана проводят в изотермическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*(PC4H10/PC4H8)*(1-P C4H8*PH2/( PC4H10*Kp)) (м3С4H10/м3*с)
Зависимость константы скорости прямой реакции от температуры:
Lg(K+)=9,6-9050/T
Зависимость константы равновесия от температуры:
lgKp=-6700/T +7.574
Рассчитать объём реактора, необходимого для достижения степени превращения бутана ХС4Н10=0,8 и производительность по бутену, если исходный состав (мольные доли): бутан 0,27, бутен 0,02, водород 0,01, остальное – азот, расход смеси 15000 м3/ч, температура в реакторе 1100 К, давление 0,15 МПа
3.Обоснуйте оптимальные условия синтеза метанола.
Вариант№14
1. Какие основные и побочные продукты получаются при каталитическом риформинге?
2.Дегидрирование этилбензола проводят в изотермическом реакторе полного смешения..
C6H5-C2H5= C6H5-C2H3+H2
Кинетическое уравнение:
U=k+*(PC6H5C2H5-P C6H5C2H3*PH2/Kp)/(1+Kc*(PC6H5C2H3)2)
(моль C6H5C2H5/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=exp(31,303-192740/(8,31*T))
Зависимость константы равновесия от температуры:
Kp=exp(-13,069-13127/T-3,077*10-3*T+3,6*10-7*T2+4,28*ln(T))
Зависимость константы адсорбционного равновесия от температуры:
Kc=exp(58241/(8,31*T)-3,8258)
Рассчитать объём реактора, необходимого для достижения степени превращения этилбензола ХС6Н5С2Н5=0,7 и производительность по стиролу, если исходный состав (мольные доли): этилбензол 0,19, остальное – водяной пар, расход смеси 5500 м3/ч, температура в реакторе 1050 К, давление 0,1 МПа.
3.Обосновать использование циркуляционной схемы в синтезе аммиака.
Вариант№15
1. Значение процесса изомеризации в нефтепереработке?
2.Синтез метанола проводят в изотермическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*(P*(ZH2*(ZCO/ZCH3OH)0,25-(ZCH3OH/ZCO)0,25/Kp0,5)
(моль СО/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=0,045*exp(44000/(8,31*633)-44000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=3148/T – 9.2833∙lg(T) + 3.145∙10-3∙Т – 4.2613∙10-7∙Т2 + 13.8144
Рассчитать объём реактора, необходимого для достижения степени превращения монооксида углерода ХСО=0,4 и производительность по метанолу, если исходный состав (мольные доли): монооксид углерода 0,17, водород 0,58 метанол 0,01, остальное – метан, расход смеси 52000 м3/ч, температура в реакторе 580 К, давление 25 МПа.
3.Дайте характеристику каталитического реактора поверхностного контакта.
Вариант№16
1. Селективность при окислении аммиака.
2.Разложение аммиака проводят в изотермическом реакторе полного смешения..
Кинетическое уравнение:
U=(k+/P)*((PNH3/PH21,5)0,25-PN2*PH21,5/ (PNH3*Kp))
(моль NH3/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=18,56*1015*exp(-142630/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=-2078/T+ 2.4943∙lg(T)+ 1.256∙10-4∙Т- 1.8564∙10-7∙Т2 - 2.206.
Рассчитать объём реактора, необходимого для достижения степени превращения аммиака ХNH3=0,85 и производительность по водороду, если иИсходный состав (мольные доли): аммиак 0,24, азот 0,01, водород 0,01, остальное – метан, расход смеси 6000 м3/ч, температура смеси на входе в реактор 1050 К, давление 0,1 МПа.
3.Дайте характеристику печей с кипящим слоем материала.
Вариант№17
1.Методы очистки газовых выбросов от оксидов азота.
2.Дегидрирование бензола проводят в изотермическом реакторе полного смешения.
2С6Н6=C12H10+H2
Кинетическое уравнение:
U=k+*PC6H62- k-*PC12H10*PH2 (моль C6H6/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=2,16*1015*exp(-118000/(8,31*T))
Зависимость константы скорости обратной реакции от температуры:
K-=1,35*108*exp(-46000/(8,31*T))
Рассчитать объём реактора, необходимого для достижения степени превращения бензола Х C6H6=0,8 и производительность по дифенилу, если исходный состав (мольные доли): бензол 0,26, остальное – водяной пар, расход смеси 12000 м3/ч, температура в реакторе 1000 К, давление 0,1 МПа.
3.Дайте характеристику печей обжига с распылением твердого материала.
Вариант№18
1.Методы очистки газовых выбросов от оксида углерода.
2.Синтез аммиака проводят в изотермическом реакторе полного смешения..
Кинетическое уравнение:
U=(k+/P)*(PN2*PH21,5/ PNH3-) (PNH3/PH21,5)/Кр) (моль NН3/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=205/3,6*exp(59000/(8,31*773)-59000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=2078/T- 2.4943∙lg(T)- 1.256∙10-4∙Т+ 1.8564∙10-7∙Т2 + 2.206.
Рассчитать объём реактора, необходимого для достижения степени превращения азота Х N2=0,5 и производительность по аммиаку, если исходный состав (мольные доли):, азот 0,20, водород 0,62, аммиак 0,04, остальное – метан, расход смеси 45000 м3/ч, температура в реакторе 700 К, давление 25 МПа.
3.Дайте характеристику реакторов с распылением жидкости.
Вариант№19
1.Каталитические нейтрализаторы выхлопных газов двигателей внутреннего сгорания.
2.Конверсию метана водяным паром проводят в изотермическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*РCH4*PH2O-PCO*PH23/Kp (моль СН4 /м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=(exp(38,02-11994/T))/T3
Зависимость константы равновесия от температуры:
lgKp=8.64 - 9871/T+7.14/lgT + 1.88∙10-3∙Т – 9.4∙10-7∙Т2
Рассчитать объём реактора, необходимого для достижения степени превращения метана ХСН4=0,9 и производительность по водороду, если исходный состав (мольные доли): метан 0,15,водяной пар 0,80, остальное – азот, расход смеси 35000 м3/ч, температура в реакторе 1050 К, давление 1 МПа.
3.Дайте характеристику реакторов с разбрызгиванием жидкости.
Вариант№20
1. Значение процесса гидроочистки природного газа и нефти?
2.Дегидрирование бутана проводят в изотермическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*(PC4H10/PC4H8)*(1-P C4H8*PH2/( PC4H10*Kp)) (м3С4H10/м3*с)
Зависимость константы скорости прямой реакции от температуры:
Lg(K+)=9,6-9050/T
Зависимость константы равновесия от температуры:
lgKp=-6700/T +7.574
Рассчитать объём реактора, необходимого для достижения степени превращения бутана ХС4Н10=0,8 и производительность по бутену, если исходный состав (мольные доли): бутан 0,22, бутен 0,02, водород 0,01, остальное – азот, расход смеси 12000 м3/ч, температура в реакторе 1100 К, давление 0,15 МПа
3.Дайте характеристику реакторов с пленочным режимом абсорбции.
Вариант№21
1.Какие продукты химической промышленности получаются каталитическим путем?
2.Синтез метанола проводят в адиабатическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*(P*(ZH2*(ZCO/ZCH3OH)0,25-(ZCH3OH/ZCO)0,25/Kp0,5)
(моль СО/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=0,045*exp(44000/(8,31*633)-44000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=3148/T – 9.2833∙lg(T) + 3.145∙10-3∙Т – 4.2613∙10-7∙Т2 + 13.8144
Рассчитать объём реактора, необходимого для достижения степени превращения монооксида углерода ХСО=0,5 и производительность по метанолу, если исходный состав (мольные доли): монооксид углерода 0,19, водород 0,54, метанол 0,01, остальное – метан, расход смеси 50000 м3/ч, температура смеси на входе в реактор 550 К, давление 25 МПа.
3.Дайте характеристику реакторов для гомогенных процессов.
Вариант№22
1.Какие продукты нефтепереработки получаются каталитическим путем?
2.Дегидрирование этилбензола проводят в адиабатическом реакторе полного смешения..
C6H5-C2H5= C6H5-C2H3+H2
Кинетическое уравнение:
U=k+*(PC6H5C2H5-P C6H5C2H3*PH2/Kp)/(1+Kc*(PC6H5C2H3)2)
(моль C6H5C2H5/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=exp(31,303-192740/(8,31*T))
Зависимость константы равновесия от температуры:
Kp=exp(-13,069-13127/T-3,077*10-3*T+3,6*10-7*T2+4,28*ln(T))
Зависимость константы адсорбционного равновесия от температуры:
Kc=exp(58241/(8,31*T)-3,8258)
Рассчитать объём реактора, необходимого для достижения степени превращения этилбензола ХС6Н5С2Н5=0,65 и производительность по стиролу, если исходный состав (мольные доли): этилбензол 0,18, остальное – водяной пар, расход смеси 5000 м3/ч, температура смеси на входе в реактор 900 К, давление 0,1 МПа.
3.Дайте характеристику реакторов с фильтрующим слоем твердого реагента.
Вариант№23
1.Дайте характеристику каталитическим процессам в химической промышленности.
2.Дегидрирование бутана проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*(PC4H10/PC4H8)*(1-P C4H8*PH2/( PC4H10*Kp)) (м3С4H10/м3*с)
Зависимость константы скорости прямой реакции от температуры:
Lg(K+)=9,6-9050/T
Зависимость константы равновесия от температуры:
lgKp=-6700/T +7.574
Рассчитать объём реактора, необходимого для достижения степени превращения бутана ХС4Н10=0,75 и производительность по бутену, если исходный состав (мольные доли): бутан 0,32, бутен 0,02, водород 0,01, остальное – азот, расход смеси 15000 м3/ч, температура смеси на входе в реактор 1100 К, давление 0,1 МПа
3.Дайте характеристику каскада реакторов с механическими мешалками.
Вариант№24
1. Дайте характеристику каталитическим процессам в нефтепереработке.
2.Разложение метанола проводят в адиабатическом реакторе полного смешения..
Кинетическое уравнение:
U=k+*P*((ZCH3OH/ZCO)0,25*Kp0,5-ZH2*(ZCO/ ZCH3OH)0,25)
(моль CH3OH/м3*)
Зависимость константы скорости прямой реакции от температуры:
K+=0,041*exp(440000/(8,31*573)-44000/(8,31*T))
Зависимость константы равновесия от температуры:
lgKp=-3886/T+8,142*lg(T)-2,47*10-3*T+0,27*10-6*Т2+0,014*105/T2-10,826
Рассчитать объём реактора, необходимого для достижения степени превращения метанола ХСН3ОН=0,6 и производительность по водороду, если исходный состав (мольные доли): метанол 0,3, монооксид углерода 0,01, водород 0,01, остальное – водяной пар, расход смеси 8000 м3/ч, температура смеси на входе в реактор 900 К, давление 0,1 МПа.
3.Структура связей ХТС.
Вариант№25
1. Дайте характеристику каталитическим процессам, применяемым в водородной энергетике.
2.Конверсию монооксида углерода водяным паром проводят в адиабатическом реакторе полного смешения.
Кинетическое уравнение:
U=k+*P*(ZCO-ZCO2*ZH2/(ZH2O*Kp) (мольСО/м3*с)
Зависимость константы скорости прямой реакции от температуры:
K+=(9000/22,4)*exp((40000/8,31)*(1/498-1/T))
Зависимость константы равновесия от температуры:
lgKp=2485.5/T + 1.565∙lg(T) – 0.066∙10-3∙Т – 0.207∙105/Т2 - 6.946
Рассчитать объём реактора, необходимого для достижения степени превращения монооксида углерода ХСО=0,7 и производительность по водороду, если: исходный состав (мольные доли): монооксид углерода 0,15, водяной пар 0,5, водород 0,1, диоксид углерода 0,05, остальное – азот; расход смеси 10000 м3/ч, температура смеси на входе в реактор 650 К, давление 0,1 МПа.
3.Сырьевая подсистема ХТС.
Рекомендуемая литература.
1.Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология.-М.: Высш. шк., 1990. – 520 с.
2.Общая химическая технология. В 2-х т. Т.2. Важнейшие химичесие производства/И.П.Мухленов, А.Я.Авербух, Д.А.Кузнецова и др.; Под. ред. И.П. Мухленова.-М.: Высш. шк., 1984. – 263 с.
3.Кузнецов Л.Д. Синтез аммиака.- М.: Химия, 1982.
4.Производство аммиака/Под ред. В.П.Семенова. М.: Химия, 1985. -368 с.
5.Справочник азотчика/Под ред. Е.Я.Мельникова.- М.: Химия, 1986. Т.1. 512 с.; 1987. Т2. 464 с.
6.Технология синтетического метанола/Караваев М.М., Леонов В.Е., Попов И.Г. и др./Под ред. М.М.Караваева.- М.: Химия, 1984. – 240 с.
7.Боресков Г.К. Гетерогенный катализ. –М.: Наука, 1986. -304 с.
8.Катализ в промышленности: В 2-х т. Т. 1./Под ред. Б. Линча.-М.: Мир, 1986. -324 с.
9.Томас Ч. Промышленные каталитические процессы и эффективные катализаторы.-М.: Мир. 1973. -385 с.
10.Мухленов И.П., Анохин В.Н., Проскуряков В.А. Катализ в кипящем слое.-М.: Химия, 1978.
Приложение 1.
Зависимость константы равновесия от температуры.
| Реакция | Уравнение lgKa=f(T) |
| 2Cl2+2H2O (г)=4HCl+O2 | 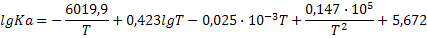
|
| CO+Cl2=COCL2 (г) | 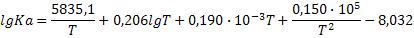
|
| 2H2+O2=2H2O (г) | 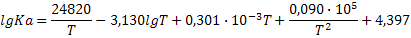
|
| 2CO+O2=2CO2 | 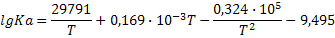
|
| CO+H2O (г)=H2+CO2 | 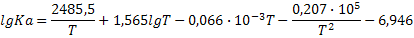
|
| 2H2+S2 (г)=2H2S (г) | 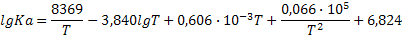
|
| 2SO2+O2=2SO3 | 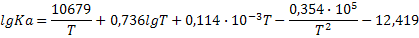
|
| N2+3H2=2NH3 | 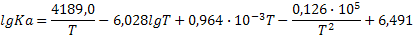
|
| 2NO+O2=2NO2 | 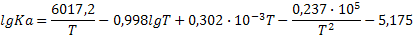
|
| N2+O2=2NO | 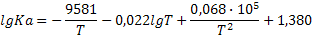
|
| 2NO2=N2O4 | 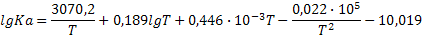
|
| C+2H2=CH4 | 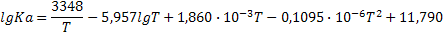
|
| 2C+O2=2CO | 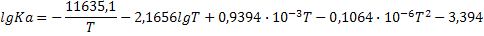
|
| 2C+2H2=C2H4 | 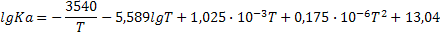
|
| C+2H2O=CO2+2H2 | 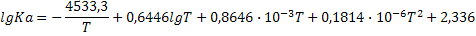
|
| CH4+H2O=CO2+3H2 | 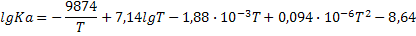
|
Приложение 2
Термодинамические свойства веществ.
| Вещество | ∆H0f,298, кДж/моль | S0298, Дж/моль∙K | ∆G0f,298, кДж/моль | Cp,298, Дж/моль∙K |
| Cl2 | 222,98 | 33,93 | ||
| H2O (г) | -241,81 | 188,72 | -228,61 | 33,61 |
| HCl | -92,31 | 186,79 | -95,30 | 29,14 |
| O2 | 205,04 | 29,37 | ||
| CO | -110,53 | 197,55 | -137,15 | 29,14 |
| COCl2 | -219,50 | 283,64 | -205,31 | 57,76 |
| H2 | 130,52 | 28,83 | ||
| CO2 | -393,51 | 213,66 | -394,37 | 37,11 |
| S2 | 128,37 | 228,03 | 79,42 | 32,51 |
| H2S | -20,60 | 205,70 | -33,50 | 33,44 |
| SO2 | -296,90 | 248,07 | -300,21 | 39,87 |
| SO3 | -395,85 | 256,69 | -371,17 | 50,09 |
| N2 | 191,50 | 29,12 | ||
| NH3 | -45,94 | 192,66 | -16,48 | 35,16 |
| NO | 91,26 | 210,64 | 87,58 | 29,86 |
| NO2 | 34,19 | 240,06 | 52,29 | 36,66 |
| N2O4 | 11,11 | 304,35 | 99,68 | 79,16 |
| CH3OH | -201,00 | 239,76 | -162,38 | 44,13 |
| CH3COOH | -434,84 | 282,50 | -376,68 | 66,50 |
| C2H4 | 52,30 | 219,45 | 68,14 | 43,56 |
| C2H5OH | -234,80 | 281,38 | -167,96 | 65,75 |
| C | 5,74 | 8,54 | ||
| CH4 | -74,85 | 186,27 | -50,85 | 35,71 |
|
из
5.00
|
Обсуждение в статье: Контрольная работа №3 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

