 |
Главная |
Классификация электродов
|
из
5.00
|
Электроды в зависимости от устройства и типа, протекающих в них реакций делятся на электроды: первого, второго и третьего рода.
Электроды первого рода
Электродами первого рода называются электроды состоящие из металла, опущенного в раствор своей хорошо растворимой соли:
Cu│CuSO4; Fe│FeCl3; Al│AlCl3
К электродам первого рода в качестве исключения относятся водородный электрод, его устройство отличается от электродов первого рода. К ним он относится только по типу реакции:
2Н+ + 2е  Н2.
Н2.
Замечательным достоинством НВЭ является то, что его потенциал равен 0 В, т.е. получается, что измеряемая ЭДС по величине равна электродному потенциалу изучаемого электрода.
Потенциал электрода, погруженного в раствор соответствующей соли с активностью ионов 1 моль-ион/л, измеренный относительно НВЭ, называется нормальным электродным потенциалом.
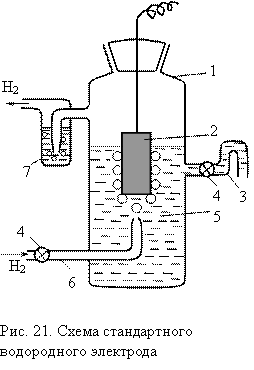 Нормальный водородный электрод
Нормальный водородный электрод
Он представляет собой платиновую пластинку, покрытую платиновой чернью, опущенную в раствор серной кислоты с активностью ионов водорода [H+] = 1 моль-ион/л. Через раствор пропускают водород при этом он в большом количестве поглощается платиновой чернью, которой покрыт платиновый электрод. В результате этого поверхность пластины покрыта большим количеством водорода.
Равновесный электродный потенциал устанавливается на границе: газообразный водород на платиновой пластине и ионы водорода в растворе.
Схема водородного электрода записывается:
Pt(H2) | H+. 
При эксплуатации НВЭ возникает ряд проблем:
1. Проблема получения водорода.
2. Проблема поддержания давления водорода постоянным Р(Н2) = 1 атм.
3. Большое усложнение установки (выпрямитель, устройство для электролиза NaOH, очистка водорода от примесей).
Электроды второго рода
Электродом II рода называется электрод, представляющий собой металл, покрытый слоем своей трудно растворимой соли, содержащей одноименный анион и обратимый вокруг этого аниона. Примерами электродов II рода могут служить каломельный и хлорсеребряный электроды.
Каломельный электрод состоит из металлической ртути и раствора KCl, насыщенного относительно каломели:
Hg, Hg2Cl2 | Cl-.
При работе каломельного электрода протекает следующая реакция:
2Hg0 + 2Cl-  Hg2Cl2 + 2e.
Hg2Cl2 + 2e.
Каломельный электрод промышленного изготовления представляет собой стеклянную трубку с шариком на конце, заполненную ртутью (1), и каломелью (2). Трубка заполнена раствором хлорида калия (3). Соединение с другим раствором осуществляется через капилляр (солевой мостик) (4). В нижнюю часть шарика впаяна платиновая проволока (5) для контакта.
Каломель готовят истиранием в агатовой ступке металлической ртути с кристаллами KCl в присутствии нескольких капель воды. В результате получается серая пастообразная масса – каломель.
Раствор KCl используется виде трех концентраций: 1н; 0,1н; насыщенный.
Потенциал КЭ при постоянных условиях является очень стабильным, однако потенциалы сильно разняться в зависимости от концентрации раствора и температуры.
В качестве электрода используют Pt с другим электродом. КЭ соединяется с помощью полунепроницаемой перегородке.
Характеристика КЭ:
+ очень устойчив в работе; долго держит постоянный потенциал;
- содержит ртуть.
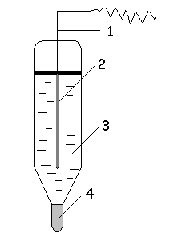 Хлорсеребряный электрод в настоящее время является более распространенным электродом.
Хлорсеребряный электрод в настоящее время является более распространенным электродом.
Хлорсеребряный электрод представляет собой стеклянную трубку, внутри которой помещена серебряная проволочка (1), покрытая плохо растворимой солью хлорида серебра AgCl (2), погруженная в насыщенный раствор хлорида калия (3). Солевой мостик представлен узким отверстием, заполненным асбестом (4).
Хлорсеребряные электроды входят в комплекты многих лабораторных измерительных приборов, выпускаются промышленностью, каждый электрод имеет свой паспорт, где указывается его потенциал.
В среднем потенциал хлорсеребряного электрода равен, Ехс = 0,222 В.
Записывается хлорсеребряный потенциал, следующим образом:
Ag, AgCl | Cl-.
При его работе осуществляется следующая реакция:
Ago + Cl- ® AgCl +  .
.
Потенциал хлорсеребряного электрода можно вывести из уравнения Нернста для электродов I рода:
Exc = Eo + 0,059 lg[Ag+].
Так как хлорид серебра является малорастворимой солью, то концентрацию ионов серебра для реакции: AgCl ↔ Ag+ +Cl-, можно вычислить из произведения растворимости соли: ПР = [Ag+] [Cl-].
Отсюда находим концентрацию ионов серебра:
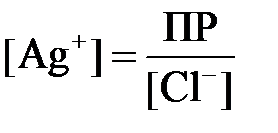
Подставляем полученное значение в уравнение Нернста:
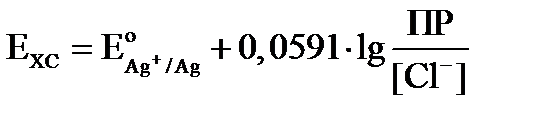
Расписываем логарифм частного как разность логарифмов:

Величина 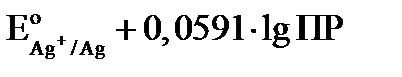 и обозначим её как
и обозначим её как 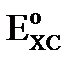 , тогда уравнение Нернста для электродов II рода имеет вид:
, тогда уравнение Нернста для электродов II рода имеет вид:
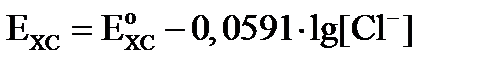 (9)
(9)
Хлорсеребряный электрод в настоящее время является самым распространенным электродом, так как обладает следующими достоинствами:
1. держит постоянный потенциал в течение очень длительного времени,
2. механически устойчив,
3. не капризен в работе,
4. работает в среде окислителей и восстановителей,
5. может применяться в реакциях нейтрализации, осаждения, комплексообразования, окисления-восстановления.
К его недостаткам можно отнести погрешности, возникающие в случае, если анализируемый раствор содержит ионы Cl- и (или) Ag+.
|
из
5.00
|
Обсуждение в статье: Классификация электродов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

