 |
Главная |
Определение сульфатов
|
из
5.00
|
Вывод формулы для расчета Ph.
[H]=[NH4OH]=Cсоли гидр 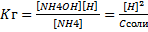 [H]=
[H]= 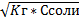 =
= 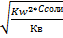
[NH4]=Cисх – Ссоли гидр = ССоли
pH=-Lg[H]=7-1/2pKb-1/2lgCcоли
Степень гидролиза.
Степень гидролиза соли выражается отношением числа гидролизованных молекул к общему числу молекул соли в растворе.
H= 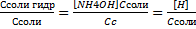
[NH4OH]=[H]=h*Cсоли
Кг= 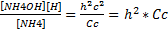
[NH4]=Cc-Cc.г.=Cc-h*Cc=Cc*(1-h)
Hгидр= 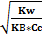
10. Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Факторы, влияющие на степень гидролиза.
Поскольку гидролиз обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, практически не влияет давление. Исключается из рассмотрения вода, так как ее концентрация в водных растворах практически постоянна (~55 моль/л).
Температура. Поскольку реакция гидролиза эндотермическая, то повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье, повышение концентрации ионов водорода приведет к смещению равновесия влево. Степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции рассмотренной.
Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо, в соответствии с принципом Ле Шателье, но степень гидролиза уменьшается. Понять это помогает константа равновесия. Да, при добавлении соли, то есть фосфат-ионов , равновесие будет смещаться вправо, концентрация гидрофосфат и гидроксид-ионов будет возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что для того, чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH–] / [PO43–], уменьшится вдвое.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье, такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно при разбавлении равновесие смещается в сторону протекания этой реакции, вправо, степень гидролиза возрастает. К этому же выводу придем из рассмотрения константы гидролиза.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди раствора гидроксида натрия, содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и, по принципу Ле Шателье, равновесие в системе сместится вправо, степень гидролиза возрастет. А если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза) а наоборот, влево, из-за связывания ионов меди в практически нерастворимый сульфид меди.



11. 





*12) Равновесие в водных р-рах кислот и оснований. Буферные растворы. Буферная емкость. Вывод формулы для расчета рН ацетатной буферной смеси. В водном растворе слабой кислоты устанавливается равновесие: HF + H2O D F– + H3O+, в котором участвуют две кислотно-основные пары: HF/F– и H3O+/H2O. Сила кислоты HF количественно характеризуется ее константой кислотности КА: 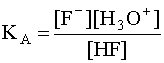 .Чем больше численное значение константы кислотности, тем сильнее данная кислота и слабее сопряженное с ней основание. В общем случае константа кислотности может быть записана следующим образом:
.Чем больше численное значение константы кислотности, тем сильнее данная кислота и слабее сопряженное с ней основание. В общем случае константа кислотности может быть записана следующим образом: 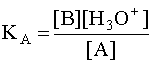 (4) , де [A] и [B] - равновесные концентрации кислоты и сопряженного с ней основания. Наиболее важной химической характеристикой водного раствора является его водородный показатель pH = - lg [H3O+]. Если в водном растворе присутствует только рассматриваемая кислота A и ее сопряженное основание B, то, учитывая, что в состоянии равновесия [B]=[H3O+], а также приняв, что равновесная концентрация [A] в первом приближении равна исходной концентрации этой кислоты, то есть [A] » CA, имеем
(4) , де [A] и [B] - равновесные концентрации кислоты и сопряженного с ней основания. Наиболее важной химической характеристикой водного раствора является его водородный показатель pH = - lg [H3O+]. Если в водном растворе присутствует только рассматриваемая кислота A и ее сопряженное основание B, то, учитывая, что в состоянии равновесия [B]=[H3O+], а также приняв, что равновесная концентрация [A] в первом приближении равна исходной концентрации этой кислоты, то есть [A] » CA, имеем 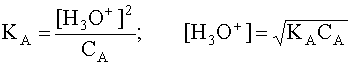 . Прологарифмируем это равенство и произведем алгебраические преобразования:
. Прологарифмируем это равенство и произведем алгебраические преобразования: 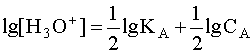 .
.
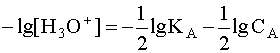 .
. 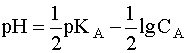 (5). Когда имеем раствор основания B, то в нем устанавливается равновесие: B + H2O D A + OH––, характеризующиеся константой основности
(5). Когда имеем раствор основания B, то в нем устанавливается равновесие: B + H2O D A + OH––, характеризующиеся константой основности 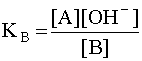 (6). Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды
(6). Чем больше численное значение константы основности, тем это основание сильнее и тем слабее сопряженная с ним кислота. В справочной литературе обычно приводятся только константы кислотности, но поскольку для любой сопряженной кислотно-основной пары произведение константы кислотности на константу основности есть величина постоянная, равная ионному произведению воды 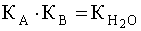 ,то соотношение (6) можно записать следующим образом:
,то соотношение (6) можно записать следующим образом: 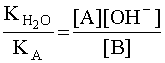 . С учетом того, что [A] = [OH–], а [B] » CB, имеем:
. С учетом того, что [A] = [OH–], а [B] » CB, имеем: 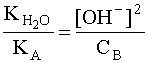 . Откуда
. Откуда 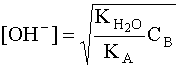 . Прологарифмировав это выражение и произведя соответствующие преобразования, получим:
. Прологарифмировав это выражение и произведя соответствующие преобразования, получим: 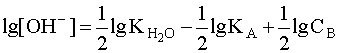 .
.
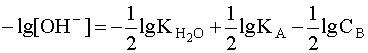 .
.
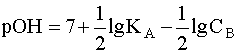 .
.
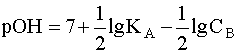 .
.
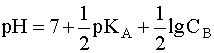 (7)
(7)
Для расчета рН раствора слабой кислоты или слабого основания можно вывести и другое выражение, в которое не входит исходная концентрация С растворенного вещества. Для этого следует прологарифмировать выражение (4) и выразить рН раствора следующим образом:
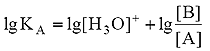 .
.
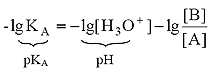 .
.
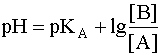 (8)
(8)
Данное уравнение выведено, исходя из выражения константы кислотности (1), однако оно пригодно и для вычисления рН раствора основания В, сопряженного с кислотой А, в чем Вы можете убедиться, выведя его из выражения константы основности (6). В дальнейшем будем пользоваться только константами кислотности (К) и их показателями (рК). Буферные растворы—растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. БУФЕРНЫЙ РАСТВОР, поддерживает при изменении состава среды постоянство значения к.-л. характеристики, напр. рН (кислотно-основной буферный раствор) или окислит.-восстановит. потенциала (окислит.-восстановит. буферный раствор). Значение рН кислотно-основного буферного раствора зависит от концентраций компонентов буферной смеси, находящихся в хим. равновесии, и мало меняется при концентрировании и разбавлении р-ра, введении относительно небольших кол-в в-в, взаимодействующих с одним из компонентов буферного раствора. Наиб. распространены водные кислотно-основные буферные растворы. Они содержат слабую к-ту НА и сопряженное с ней основание А -, напр. СН3СООН и СН3СОО-, NH4+ и NH3. В таких системах осуществляется равновесие: 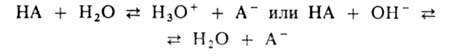 По данным о константе диссоциации к-ты Ка = — [Н3О+] [А- ] /[НА] определяют значение рН р-ра:
По данным о константе диссоциации к-ты Ка = — [Н3О+] [А- ] /[НА] определяют значение рН р-ра: 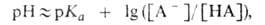 где [НА] и [А-] -равновесные концентрации соотв. к-ты и основания, рКа= —lgКа. Это значение рН остается практически постоянным, т.к. при добавлении небольших кол-в сильных к-т или оснований ионы Н3О+ или ОН-связываются основанием (к-той) с образованием сопряженной к-ты (основания). Количественно буферный раствор характеризуется буферной емкостью- производной , где X - характеристика среды, с - концентрация одного из компонентов буферной смеси или добавленного в-ва, количественно реагирующего с одним из компонентов с образованием другого. Емкость кислотно-основного буферного раствора соответствует числу эквивалентов сильной к-ты или сильного основания, к-рое необходимо добавить к 1 л р-ра, чтобы изменить его рН на единицу. Буферная емкость возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Буферные св-ва проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферный раствор часто готовят смешением р-ров равной концентрации обоих компонентов либо прибавлением к р-ру одного компонента соответствующего кол-ва реагента, приводящего к образованию равной концентрации сопряженной формы. Интервал рН (равный обычно рКа ± 1), в к-ром данная буферная система может поддерживать постоянное значение рН, наз. областью буферирования. В справочной литературе имеются подробные рецепты приготовления кислотно-основных буферных растворов для разл. значений рН. Окислит.-восстановит. буферный раствор содержит смесь соед. элементов переменной валентности в двух степенях окисления (т. е. смесь обеих форм окислит.-восстановит. пары), напр. Fe(III) и Fe(II). Значение окислит.-восстановит. потенциала такого буферного раствора определяется по ф-ле:
где [НА] и [А-] -равновесные концентрации соотв. к-ты и основания, рКа= —lgКа. Это значение рН остается практически постоянным, т.к. при добавлении небольших кол-в сильных к-т или оснований ионы Н3О+ или ОН-связываются основанием (к-той) с образованием сопряженной к-ты (основания). Количественно буферный раствор характеризуется буферной емкостью- производной , где X - характеристика среды, с - концентрация одного из компонентов буферной смеси или добавленного в-ва, количественно реагирующего с одним из компонентов с образованием другого. Емкость кислотно-основного буферного раствора соответствует числу эквивалентов сильной к-ты или сильного основания, к-рое необходимо добавить к 1 л р-ра, чтобы изменить его рН на единицу. Буферная емкость возрастает при увеличении начальных концентраций его компонентов и максимальна при их равенстве. Буферные св-ва проявляются очень слабо, если концентрация одного компонента в 10 раз и более отличается от концентрации другого. Поэтому буферный раствор часто готовят смешением р-ров равной концентрации обоих компонентов либо прибавлением к р-ру одного компонента соответствующего кол-ва реагента, приводящего к образованию равной концентрации сопряженной формы. Интервал рН (равный обычно рКа ± 1), в к-ром данная буферная система может поддерживать постоянное значение рН, наз. областью буферирования. В справочной литературе имеются подробные рецепты приготовления кислотно-основных буферных растворов для разл. значений рН. Окислит.-восстановит. буферный раствор содержит смесь соед. элементов переменной валентности в двух степенях окисления (т. е. смесь обеих форм окислит.-восстановит. пары), напр. Fe(III) и Fe(II). Значение окислит.-восстановит. потенциала такого буферного раствора определяется по ф-ле: 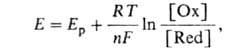 де Ер- реальный потенциал пары в данной среде, [Ох] и [Red]-концентрации соотв. ее окисленной и восстановленной форм, n - число электронов, участвующих в окислит.-восстановит. р-ции, R - универсальная газовая постоянная, F- число Фарадея, T - абс. т-ра. В методах фотометрии пламени (в т.ч. в атомно-абсорбционном анализе) буферными называют р-ры, поддерживающие практически постоянное значение характеристики не самого р-ра, а пламени, в к-рое они вдуваются. Напр., такие легкоионизирующиеся в-ва, как соли К, обеспечивают концентрацию электронов в пламени, необходимую для подавления ионизации определяемых атомов. В электрохим. методах анализа буферным иногда называют р-р, препятствующий смешению р-ров вблизи анода и катода. Буферная емкость-число эквивалентов N кислоты или основания, необходимое для смещения рН одного литра буферного раствора на 1 единицу называется буферной емкостью: В =N/ ( pH1 – pH0 ), где pH1 - рН буферного раствора после добавления кислоты или основания; pH0 – рН исходного раствора. Буферная емкость раствора тем больше, чем больше концентрация компонентов буфера (кислоты и её соли, основания и его соли). *13) Виды титрования. Эквивалент. Молярная, нормальная, процентная концентрации. Титр. Вычисление массы эквивалента в различных методах анализа. Скачок титрования. Точка эквивалентности и конца титрования. Различают прямое, обратное титрование: При прямом титровании к раствору определяемого вещества (аликвоте или навеске, титруемому веществу) добавляют небольшими порциями раствор титранта (рабочий раствор). При обратном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию. Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях. Например, в реакции: NaOH + HCl = NaCl + H2O эквивалентом будет реальная частица — ион Na+, в реакции Zn(OH)2 + 2HCl = ZnCl2 + 2H2O эквивалентом будет являться мнимая частица ½Zn(OH)2. Эквивалентная молярная масса вещества:Молярная масса эквивалентов обычно обозначается как
де Ер- реальный потенциал пары в данной среде, [Ох] и [Red]-концентрации соотв. ее окисленной и восстановленной форм, n - число электронов, участвующих в окислит.-восстановит. р-ции, R - универсальная газовая постоянная, F- число Фарадея, T - абс. т-ра. В методах фотометрии пламени (в т.ч. в атомно-абсорбционном анализе) буферными называют р-ры, поддерживающие практически постоянное значение характеристики не самого р-ра, а пламени, в к-рое они вдуваются. Напр., такие легкоионизирующиеся в-ва, как соли К, обеспечивают концентрацию электронов в пламени, необходимую для подавления ионизации определяемых атомов. В электрохим. методах анализа буферным иногда называют р-р, препятствующий смешению р-ров вблизи анода и катода. Буферная емкость-число эквивалентов N кислоты или основания, необходимое для смещения рН одного литра буферного раствора на 1 единицу называется буферной емкостью: В =N/ ( pH1 – pH0 ), где pH1 - рН буферного раствора после добавления кислоты или основания; pH0 – рН исходного раствора. Буферная емкость раствора тем больше, чем больше концентрация компонентов буфера (кислоты и её соли, основания и его соли). *13) Виды титрования. Эквивалент. Молярная, нормальная, процентная концентрации. Титр. Вычисление массы эквивалента в различных методах анализа. Скачок титрования. Точка эквивалентности и конца титрования. Различают прямое, обратное титрование: При прямом титровании к раствору определяемого вещества (аликвоте или навеске, титруемому веществу) добавляют небольшими порциями раствор титранта (рабочий раствор). При обратном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию. Эквивалент вещества или Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях. Например, в реакции: NaOH + HCl = NaCl + H2O эквивалентом будет реальная частица — ион Na+, в реакции Zn(OH)2 + 2HCl = ZnCl2 + 2H2O эквивалентом будет являться мнимая частица ½Zn(OH)2. Эквивалентная молярная масса вещества:Молярная масса эквивалентов обычно обозначается как 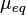 или
или 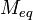 . Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как
. Отношение эквивалентной молярной массы вещества к его собственно молярной массе называется фактором эквивалентности (обозначается обычно как 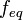 ). Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества. Mэкв = fэкв×M. Фактор эквивалентности:Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как
). Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества. Mэкв = fэкв×M. Фактор эквивалентности:Отношение эквивалентной молярной массы к его собственной молярной массе называется фактором эквивалентности (обозначается обычно как 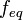 ). *Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации
). *Молярная концентрация — количество растворённого вещества (число молей) в единице объёма раствора. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также распространено выражение в «молярности». Возможно другое обозначение молярной концентрации 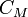 , которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. п.
, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным. Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. п.
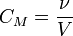 ,где: ν — количество растворённого вещества, моль; V — общий объём раствора, л. Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
,где: ν — количество растворённого вещества, моль; V — общий объём раствора, л. Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. 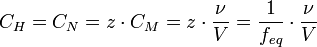 , где: ν — количество растворённого вещества, моль; V — общий объём раствора, л; z — число эквивалентности (фактор эквивалентности
, где: ν — количество растворённого вещества, моль; V — общий объём раствора, л; z — число эквивалентности (фактор эквивалентности 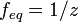 ). Процентная концентрация раствора – это величина, показывающая отношение массы растворенного вещества к общей массе раствора. Иными словами, это – массовая доля вещества в растворе, выраженная в процентах. Титр раствора — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³). Различают титр по растворённому веществу и титр по определяемому веществу (условный титр). Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора. Рассчитывается по формуле:
). Процентная концентрация раствора – это величина, показывающая отношение массы растворенного вещества к общей массе раствора. Иными словами, это – массовая доля вещества в растворе, выраженная в процентах. Титр раствора — способ выражения концентрации, применяемый, в основном, в аналитической химии. Обозначается заглавной латинской буквой T (тэ). Измеряется в г/мл (г/см³). Различают титр по растворённому веществу и титр по определяемому веществу (условный титр). Титр по растворённому веществу или просто титр — масса растворённого вещества (в граммах), содержащаяся в одном миллилитре (см³) раствора. Рассчитывается по формуле:
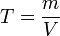 где
где 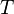 — титр раствора (в г/мл),
— титр раствора (в г/мл), 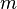 — масса растворённого вещества (в г),
— масса растворённого вещества (в г), 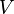 — объём раствора (в мл). Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора. Рассчитывается по формуле:
— объём раствора (в мл). Титр по определяемому веществу или условный титр — масса какого-либо вещества (в граммах), реагирующая с одним миллилитром данного раствора. Иными словами: масса определяемого вещества, оттитровываемая одним миллилитром раствора. Рассчитывается по формуле: 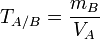 ,где
,где 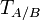 — титр раствора вещества A по веществу B (в г/мл),
— титр раствора вещества A по веществу B (в г/мл), 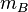 — масса вещества B, взаимодействующего с данным раствором (в г),
— масса вещества B, взаимодействующего с данным раствором (в г), 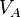 — объём раствора вещества A (в мл). Условный титр и титр по растворённому веществу связаны следующей формулой:
— объём раствора вещества A (в мл). Условный титр и титр по растворённому веществу связаны следующей формулой: 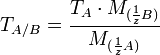 ,где
,где 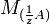 и
и 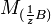 — молярные массы эквивалентов веществ A и B соответственно. *Скачок титрования, т. е. резкое изменение рН вблизи точки эквивалентности, тем больше, чем сильнее титруемая к-та (основание) и чем выше ее концентрация. Чем больше скачок, тем меньше погрешность определения. *Точка эквивалентности и конечная точка титрования. Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности. Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, приба-вляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,02-0,04 мл (1-2 капли) титранта. Это то количество титранта, которое необходимо для взаимодейcтвия с индикатором. *14)Кислотно-основное титрование. Определение содержания щёлочи в растворе (реакция, условия проведения титрования, индикатор, расчётные формулы). В основе метода кислотно-основного титрования лежит реакция нейтрализации:
— молярные массы эквивалентов веществ A и B соответственно. *Скачок титрования, т. е. резкое изменение рН вблизи точки эквивалентности, тем больше, чем сильнее титруемая к-та (основание) и чем выше ее концентрация. Чем больше скачок, тем меньше погрешность определения. *Точка эквивалентности и конечная точка титрования. Согласно правилу эквивалентности титрование необходимо продолжать до тех пор, пока количество прибавленного реагента не станет эквивалентным содержанию определяемого вещества. Наступающий в процессе титрования момент, когда количecтвo стандартного раствора реагента (титранта) становится теоретически строго эквивалентным количеству определяемого вещества согласно определенному уравнению химической реакции, называют точкой эквивалентности. Точку эквивалентности устанавливают различными способами, например по изменению окраски индикатора, приба-вляемого в титруемый раствор. Момент, при котором происходит наблюдаемое изменение цвета индикатора, называют конечной точкой титрования. Очень часто конечная точка титрования не совсем совпадает с точкой эквивалентности. Как правило, они отличаются друг от друга не более чем на 0,02-0,04 мл (1-2 капли) титранта. Это то количество титранта, которое необходимо для взаимодейcтвия с индикатором. *14)Кислотно-основное титрование. Определение содержания щёлочи в растворе (реакция, условия проведения титрования, индикатор, расчётные формулы). В основе метода кислотно-основного титрования лежит реакция нейтрализации: 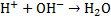 .Пользуясь эти методом можно определять кроме кислот и щёлочей так и некоторые соли, имеющие сильнощелочную реакцию. Основными рабочими растворами являются кислоты, обычно серная и соляная, и щёлочи, обычно NaOH и KOH. Эти вещества не отвечают требованиям к стандартным растворам, поэтому их концентрацию приходится устанавливать. Для стандартизации кислот обычно используют буру – тетраборат натрия
.Пользуясь эти методом можно определять кроме кислот и щёлочей так и некоторые соли, имеющие сильнощелочную реакцию. Основными рабочими растворами являются кислоты, обычно серная и соляная, и щёлочи, обычно NaOH и KOH. Эти вещества не отвечают требованиям к стандартным растворам, поэтому их концентрацию приходится устанавливать. Для стандартизации кислот обычно используют буру – тетраборат натрия 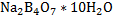 или безводный карбонат натрия – соду. Для стандартизации щелочей обычно берут щавелевую
или безводный карбонат натрия – соду. Для стандартизации щелочей обычно берут щавелевую 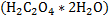 или янтарную
или янтарную 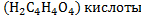 . Определение конечной точки титрования прями связано и рН раствора. Если титровать раствор любой кислоты раствором любой щёлочи, то Ионы постепенно связывают ионы кислоты в воду и концентрация их уменьшается, а рН раствора увеличивается, соответственно в обратном случае ионы связывают и рН раствора уменьшается. При каком то определённом значении рН достигается точка эквивалентности, и титрование прекращают. Соответственно, в методе кислотно-основного титрования используют индикаторы, показывающие значения рН раствора. К индикаторам предъявляют следующие требования: 1. Окраска индикатора при близких значениях рН должна явно отличатся. 2. Изменение цвета индикатора должно происходить резко в небольшом интервале рН. 3. Окраска индикатора должна быть возможно более интенсивной. 4. Количество щёлочи или кислоты, необходимое для ихменения окраски индикатора, должно быть настолько мало, чтобы не искажались результаты титрования. 5.Изменение окраски индикатора должно быть обратимым процессом. Определение содержания щелочи (на примере NaOH).Стандартизация кислоты. В качестве первичного стандарта берут раствор буры. Суммарно уравнения стандартизации можно представить в виде:
. Определение конечной точки титрования прями связано и рН раствора. Если титровать раствор любой кислоты раствором любой щёлочи, то Ионы постепенно связывают ионы кислоты в воду и концентрация их уменьшается, а рН раствора увеличивается, соответственно в обратном случае ионы связывают и рН раствора уменьшается. При каком то определённом значении рН достигается точка эквивалентности, и титрование прекращают. Соответственно, в методе кислотно-основного титрования используют индикаторы, показывающие значения рН раствора. К индикаторам предъявляют следующие требования: 1. Окраска индикатора при близких значениях рН должна явно отличатся. 2. Изменение цвета индикатора должно происходить резко в небольшом интервале рН. 3. Окраска индикатора должна быть возможно более интенсивной. 4. Количество щёлочи или кислоты, необходимое для ихменения окраски индикатора, должно быть настолько мало, чтобы не искажались результаты титрования. 5.Изменение окраски индикатора должно быть обратимым процессом. Определение содержания щелочи (на примере NaOH).Стандартизация кислоты. В качестве первичного стандарта берут раствор буры. Суммарно уравнения стандартизации можно представить в виде: 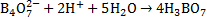 . Полное уравнение:
. Полное уравнение: 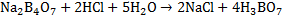 . Выполнение. С помощью пипетки Мора переносят 10 мл р-ра в колбу для титрования и добавляют 2 – 3 капли индикатора метилового оранжевого. Бюретку заполняют рабочим раствором кислоты и титруют до появления слабой персиковой окраски. Расчёт:
. Выполнение. С помощью пипетки Мора переносят 10 мл р-ра в колбу для титрования и добавляют 2 – 3 капли индикатора метилового оранжевого. Бюретку заполняют рабочим раствором кислоты и титруют до появления слабой персиковой окраски. Расчёт: 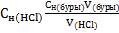 . Определение массы щёлочи. Масса щёлочи определяется на основе реакции нейтрализации кислоты щёлочью в присутствии индикатора.
. Определение массы щёлочи. Масса щёлочи определяется на основе реакции нейтрализации кислоты щёлочью в присутствии индикатора. 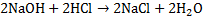 . Выполнение. К раствору щёлочи приливают мл дистиллированной воды и добавляют 2 – 3 капли индикатора – метилового оранжевого. Бюретку заполняют стандартизированным раствором HCl и титруют до появления слабой персиковой окраски. Расчёты.
. Выполнение. К раствору щёлочи приливают мл дистиллированной воды и добавляют 2 – 3 капли индикатора – метилового оранжевого. Бюретку заполняют стандартизированным раствором HCl и титруют до появления слабой персиковой окраски. Расчёты. 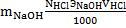
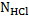 нормальная концентрация HCl, моль-экв/л,
нормальная концентрация HCl, моль-экв/л, 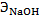 - Молярная масса эквивалента NaOН, г,
- Молярная масса эквивалента NaOН, г, 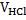 - средний объём ушедшей на титрование кислоты, мл.
- средний объём ушедшей на титрование кислоты, мл.
*15)Кислотно-основное титрование. Основные титранты. Реакции, лежащие в основе метода, способы фиксирования точки эквивалентности. Первичный стандарт и уравнение стандартизации титранта. Условия проведения титрования, расчет рабочей концентрации титранта. В основе кислотно-основного титрования положена реакция взаимодействия ионов водорода или гидроксония с гидроксид-ионами:Н+ + ОН- = Н2О, Н3О+ + ОН- = 2Н2О.При помощи этого метода определяют кислоты, основания, соли, способных гидролизоваться в водных растворах, а также их смеси, азот, серу в органических соединениях, некоторые органические соединения (формальдегид, спирты и др.). В качестве титрантов в кислотно-основном титровании применяют в основном растворы сильных кислот (НС1, Н2SО4) и сильных оснований (КОН, NaOH).В зависимости от природы титранта кислотно-основное титрование включает два основных метода:ацидиметрия и алкалиметрия. В ацидиметрии титрантом служит раствор кислоты, а применяют ее для определения различных оснований. В алкалиметрии титрант - раствор щелочи, а применяется для определения кислот,Титранты кислотно-основного титрования относятся к титрантам второго типа - стандартизированные или с установленным титром (см.3.3). В качестве исходных веществ для установления титра рабочих растворов кислот используют тетраборат натрия (Na2B4O7*10H2O) или карбонат натрия безводный (Na2CO3), а для установления титра растворов щелочей – щавелевую (Н2С2О4*2Н2О) или янтарную (Н2С4Н4О4) кислоту. Кислотно-основное титрование не сопровождается внешним эффектом, а лишь изменением рН. Реакция среды в точке эквивалентности определяется природой взаимодействующих кислот и оснований. В кислотно-основном методе титрования различают три случая титрования: 1. Титрование сильной кислоты сильной щелочью и наоборот: НСl + NaOH = NaCl + H2O; H+ + OH- = H2O. Точка эквивалентности находится в нейтральной среде (рН=7), т.к. образующаяся соль не подвергается гидролизу. 2.Титрование слабой кислоты сильной щелочью: СН3СООН + NaOH = CH 3COONa + H2O. В ионном виде:СН3COOH + OH- = CH3COO- + H2O. В точке эквивалентности образуется соль слабой кислотой и сильного основания, которая вступает в реакцию гидролиза: СH3COONa + HOH ↔ CH3COOH + NaOH. В ионном виде: СН3СОО- + НОН ↔ СН3СООН + ОН- .В растворе накапливаются ионы ОН- и точка эквивалентности будет находиться в щелочной среде (рН > 7 ), не совпадая с точкой нейтральности. 3.Титрование слабого основания сильной кислотой:NH4OH + HCl = NH4Cl + H2O.В ионном виде:NH4OH + H+ = NH4+ + H2O. Образующаяся соль слабого основания и сильной кислоты (NH4Cl) подвергается гидролизу, и в растворе накапливаются ионы Н+, что вызывает смещение точки эквивалентности в кислую среду. Следовательно, и в третьем случае точка эквивалентности не совпадает с точкой нейтральности. Поскольку кислотно-основное титрование не сопровождается внешним эффектом, например, изменением окраски, для фиксирования точки эквивалентности применяют индикаторы. 1.2 Индикаторы в кислотно-основном титровании.Индикаторы кислотно-основного титрования представляют собой слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются окраской. В процессе диссоциации эти две формы находятся в равновесии. Изменение рН в кислотно-основном титровании нарушает равновесие процесса диссоциации индикатора, что вызывает накопление в растворе одной из форм индикатора, окраску которой можно визуально наблюдать. СТАНДАРТИЗАЦИЯ. Под стандартизацией раствора титранта имеют в виду установление его точной концентрации с относительной погрешностью, обычно не превышающей ± 0,1 %. Обязательным условием этой процедуры является высокая точность определения концентрации титранта. Различают: приготовленные и установленныерастворы титрантов. Приготовленныерастворы получают путем растворения точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя (например, раствор NaCl, K2Cr2O7). Однако многие растворы таким путем приготовить нельзя, в том числе, NaOH, KMnO4. В таких случаях готовят раствор титранта приблизительной концентрации, а потом его стандартизуют, т. е. устанавливают концентрацию с необходимой точностью. Такие растворы называют установленными. Для стандартизации титрантов применяют специальные установочные вещества, так называемые первичные стандарты.Первичные стандарты – вещества, имеющие состав, точно отвечающий химической формуле. Они должны удовлетворять следующим требованиям:
· быть устойчивы на воздухе и иметь, по возможности, большую молярную массу эквивалента;
· быть доступными, легко очищаться от примесей;
· реакция вещества титранта с установочным веществом должна протекать быстро, количественно и стехиометрически.
Растворы NaOH и КОН часто стандартизуют по дифталату калия КНС8Н4О4 или дигидрату щавелевой кислоты Н2С2О4 · 2Н2О. Растворы HCl и H2SO4 стандартизуют по карбонату натрия Na2СО3 или декагидрату тетрабората натрия Na2В4О7 ·10 Н2О. Растворы КMnO4 – по оксалату натрия Na2С2О4. Иногда для стандартизации используют вторичные стандарты. В качестве вторичных стандартов выступают титрованные растворы веществ, способных взаимодействовать с титрантом. Например, стандартизацию раствора HCl можно сделать по титрованному раствору NaOH. Основное правило, которое необходимо помнить: стандартизация титранта и последующее выполнение анализа необходимо проводить в одних и тех же условиях, а для стандартизации использовать то же вещество, которое будет анализироваться в дальнейшем. Стандартные растворы готовят в мерных колбах из фиксаналов, которые содержат точно фиксированное количество вещества, обычно 0,1 моль эквивалента. При стандартизации растворов используют: 1) метод отдельных навесок; 2) метод пипетирования. Метод отдельных навесок. Рассчитывают массу навески стандартного вещества при условии, что расход титранта на её титрование составляет не более 20 мл. На аналитических весах взвешивают в бюксах три навески, которые могут отличаться от рассчитанной на ± 10 %. Затем их переносят точно в конические колбы для титрования, добавляют индикатор и титруют. Рассчитывают молярную концентрацию титранта для каждой навески стандартного вещества и расхождение между наибольшим и наименьшим результатами. Если расхождение не превышает 0.2 – 0.3 %, то берут среднее значение из всех трех результатов. В случае большего расхождения взвешивают еще одну навеску стандартного вещества, титруют её, находят четвертый результат и снова проверяют сходимость значений молярной концентрации. Метод пипетирования. При стандартизации растворов этим методом рассчитывают навеску стандартного вещества, необходимую для приготовления заданного объема раствора первичного стандарта с концентрацией, как правило. близкой к молярной концентрации титранта. Взвешенную на аналитических весах навеску твердого вещества количественно переносят в мерную колбу, растворяют, тщательно перемешивая. Аликвоту полученного раствора отбирают пипеткой, предварительно промытой этим раствором, в коническую колбу для титрования и титруют стандартизуемым раствором. Аликвота – порция вещества, содержащаяся в растворе, отобранном с помощью пипетки. При стандартизации раствора титрование проводят не менее трех раз. Если объемы, затраченные на титрование, совпадают между собой в пределах 0,2 – 0,3 %, то берут из них среднее значение и рассчитывают молярную концентрацию титранта. В случае большего расхождения проводят повторное титрование. Для приготовления стандартных растворов используют также «фиксаналы» (стандарт-титры). Фиксанал представляет собой стеклянную или пластиковую ампулу, содержащую точную навеску стандартного твердого вещества (или определенный объем титрованного раствора), необходимую для приготовления 1 литра точно 0.1 N раствора. Правила титрования: 1. Следует устанавливать титр стандартного раствора и применять один и тотже раствор в присутствии одного и того же индикатора. 2. Для титрования следует брать всегда одно и тоже количество индикатора и повторять титрование определяемого вещества несколько раз до тех пор, пока не будут получены три близко сходящихся результата. 3. Необходимо брать, как правило, не более 1-2 капель индикатора, не забывая о том, что индикаторы, применяемые в методе нейтрализации, сами являются кислотами или основаниями. На их нейтрализацию также расходуется часть раствора титранта. 4. Всегда следует титровать до одного и того же оттенка окраски раствора, используя для титрования по возможности одинаковые объемы титруемого раствора. 5. Необходимо выбирать такой индикатор, который изменяет свой цвет вблизи точки эквивалентности. Расчет результата прямого титрования при разных способах выражения концентрации раствора:Обозначения величин, относящихся к раствору определяемого вещества, будем отмечать индексом "1", а к раствору титранта – индексом "2". Если известны молярная концентрация эквивалента (нормальность) титранта C2 и объем раствора V2 в миллилитрах, израсходованный на титрование определяемого вещества, то количество вещества титранта, затраченное на реакцию, будет равно 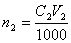 . В точке эквивалентности количество вещества титранта, израсходованное на реакцию, будет точно равно количеству определяемого вещества в анализируемом растворе (n1=n2). Поэтому
. В точке эквивалентности количество вещества титранта, израсходованное на реакцию, будет точно равно количеству определяемого вещества в анализируемом растворе (n1=n2). Поэтому 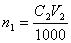 . Количество определяемого вещества (в молях эквивалента), находящееся в анализируемом растворе, можно также представить соотношением
. Количество определяемого вещества (в молях эквивалента), находящееся в анализируемом растворе, можно также представить соотношением 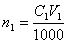 . Отсюда получаем очень важное уравнение C1V1 = C2V2 . Если известен объем анализируемого раствора, то по этому уравнению можно рассчитать его концентрацию. Масса m1 определяемого вещества в анализируемом растворе рассчитывается по соотношению
. Отсюда получаем очень важное уравнение C1V1 = C2V2 . Если известен объем анализируемого раствора, то по этому уравнению можно рассчитать его концентрацию. Масса m1 определяемого вещества в анализируемом растворе рассчитывается по соотношению 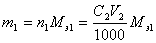 ,где Mэ1 – молярная масса эквивалента определяемого вещества. Например, пусть раствор соляной кислоты титруют раствором NaOH с молярной концентрацией эквивалента C(NaOH)=0,1048 моль/л, и на титрование израсходовано V(NaOH)=22,52 мл этого раствора. Тогда
,где Mэ1 – молярная масса эквивалента определяемого вещества. Например, пусть раствор соляной кислоты титруют раствором NaOH с молярной концентрацией эквивалента C(NaOH)=0,1048 моль/л, и на титрование израсходовано V(NaOH)=22,52 мл этого раствора. Тогда 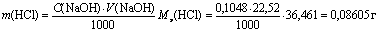 Рабочий раствор в титриметрическом анализе нередко характеризуют молярной концентрацией эквивалента с поправочным коэффициентом. Поправочный коэффициент равен отношению истинной молярной концентрации эквивалента Cист рабочего раствора к округленной табличной молярной концентрации эквивалента Cтабл, для которой заранее рассчитано, какой массе определяемого вещества соответствует данный объем рабочего раствора. Например, 22,50 мл точно 0,1000 н. NaOH нейтрализуют 0,08204 г HCl, а 22,52 мл этой щелочи – 0,08211 г HCl и т.д. Если истинная молярная концентрация эквивалента Cист=0,1048 моль/л, то поправочный коэффициент равен
Рабочий раствор в титриметрическом анализе нередко характеризуют молярной концентрацией эквивалента с поправочным коэффициентом. Поправочный коэффициент равен отношению истинной молярной концентрации эквивалента Cист рабочего раствора к округленной табличной молярной концентрации эквивалента Cтабл, для которой заранее рассчитано, какой массе определяемого вещества соответствует данный объем рабочего раствора. Например, 22,50 мл точно 0,1000 н. NaOH нейтрализуют 0,08204 г HCl, а 22,52 мл этой щелочи – 0,08211 г HCl и т.д. Если истинная молярная концентрация эквивалента Cист=0,1048 моль/л, то поправочный коэффициент равен 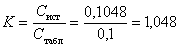 .При расчете результатов титрования табличный результат умножают на поправочный коэффициент. Если израсходовано 22,52 мл кислоты, табличный результат равен 0,08211 г и истинная масса кислоты составит m(HCl) = mтабл×K = 0,08211×1,048 = 0,08605 г. Этот способ очень удобен при серийных определениях и широко используется в цеховых и заводских лабораториях. Если известен титр T2 рабочего раствора, т.е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента титранта, вступившее в реакцию, составит
.При расчете результатов титрования табличный результат умножают на поправочный коэффициент. Если израсходовано 22,52 мл кислоты, табличный результат равен 0,08211 г и истинная масса кислоты составит m(HCl) = mтабл×K = 0,08211×1,048 = 0,08605 г. Этот способ очень удобен при серийных определениях и широко используется в цеховых и заводских лабораториях. Если известен титр T2 рабочего раствора, т.е. масса (г) растворенного вещества в 1 мл раствора, то количество вещества эквивалента титранта, вступившее в реакцию, составит 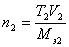 . Тогда масса определяемого вещества в анализируемом растворе будет равна
. Тогда масса определяемого вещества в анализируемом растворе будет равна 
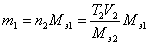 .Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора, или титра раствора по определяемому веществу T2/1. Он показывает массу определяемого вещества, которая соответствует 1 мл рабочего раствора. Поэтому масса определяемого вещества может быть рассчитана очень простым образом m1=T2/1×V2 . Если сравнить это выражение с предыдущей формулой расчета по титру рабочего раствора, то титр по определяемому веществу можно представить в виде
.Широко распространен в практике способ расчета результатов анализа с помощью условного титра рабочего раствора, или титра раствора по определяемому веществу T2/1. Он показывает массу определяемого вещества, которая соответствует 1 мл рабочего раствора. Поэтому масса определяемого вещества может быть рассчитана очень простым образом m1=T2/1×V2 . Если сравнить это выражение с предыдущей формулой расчета по титру рабочего раствора, то титр по определяемому веществу можно представить в виде 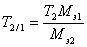 .С другой стороны, из формулы расчета массы определяемого вещества через молярную концентрацию эквивалента рабочего раствора следует, что
.С другой стороны, из формулы расчета массы определяемого вещества через молярную концентрацию эквивалента рабочего раствора следует, что 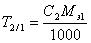 .Рассмотренными в данном разделе способами рассчитывается результат и в методе титрования по замещению. *16)Кислотно-основное титрование. Первичный стандарт и уравнение стандартизации титранта. Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации: Н3O+ ОН− = 2Н2О. Наиболее сильными основными титрантами в неводных растворах являются четвертичные аммониевые основания — гидроксиды тетраметил-, тетраэтил- и тетрабутил аммония и их производные. Основ
.Рассмотренными в данном разделе способами рассчитывается результат и в методе титрования по замещению. *16)Кислотно-основное титрование. Первичный стандарт и уравнение стандартизации титранта. Кислотно-основное титрование — титриметрические методы определения концентрации кислот или оснований, основанные на реакции нейтрализации: Н3O+ ОН− = 2Н2О. Наиболее сильными основными титрантами в неводных растворах являются четвертичные аммониевые основания — гидроксиды тетраметил-, тетраэтил- и тетрабутил аммония и их производные. Основ
|
из
5.00
|
Обсуждение в статье: Определение сульфатов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

