 |
Главная |
Определение содержания хлоридов в растворе методом Мора
|
из
5.00
|
Это метод прямого титрования.
 =
= 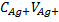
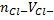 =
= 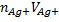
В этом методе титрант – AgNO3
В качестве индикатора используют K2Cr2O7
До т. э. Cl-(изб) + Ag+ → AgCl
Т. э. AgCl [Cl-]=[Ag+]=S(AgCl)= 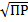
После т. э. изб Ag+ + 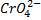 →Ag2CrO4↓ (взаимод с первой капли)
→Ag2CrO4↓ (взаимод с первой капли)
ПР(AgCrO4)>ПР(AgCl)
Метод заведомо содержит ошибку титрования. Она связана с тем, что мы всегда должны добавлять 2-3 лишние капли Ag+, т.к. осадок Ag2CrO4 выпадает после т.э. этот метод всегда ведут в слабо-кислой среде. В сильнокислой среде нельзя вести, т.к. хромат
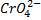 +2H+→Cr2O7 2- + H2O
+2H+→Cr2O7 2- + H2O
Ag+ + OH- → AgOH→2AgOH→Ag2O3+H2O
По методу мора можно определить хлориды и бромиды.
32. 33. 34. Равновесие в растворах комплексных соединений. Ступенчатые и общие константы диссоциации. Константа устойчивости.Комплексные соединения-сложные частицы, состоящие из составных частей способных к самостоятельному существованию. Это отдельный класс соединений для которого характерна: 1)сложность состава 2) способность составных частиц к автономному существованию. Комплексы в растворах диссоциируют ступенчато, при этом комплексные частицы выделяют 2 части 1) внешняя сфера 2)внутренняя сфера. В растворах комплексные соединения сразу же диссоциируют на комплексный ион и ион составляющий внешнюю сферу. В H2O диссоциирует, как слабый электролит.
В растворах комплексный ион находится в равновесии с частицами, из которых он образован; соответствующую константу равновесия называют константой нестойкости
 =
= 
Решение задач о нахождении концентрации свободных и комплексных ионов в растворе проводится аналогично другим задачам на равновесие.
Чем больше константа нестойкости, тем сильнее диссоциирует в растворе комплексный ион.Знание константы нестойкости позволяет:
1) находить концентрацию ионов в растворе;
2) предвидеть процесс распада комплексных ионов при добавлении осаждающих реагентов;
3) решать вопрос об использовании комплексных соединений с целью маскировки мешающих ионов.
Диссоциация комплекса идет лишь в незначительной степени и Может быть охарактеризована общей константой диссоциации, ее называют константой нестойкости или константой распада комплекса, которая является произведением констант диссоциации по отдельным ступеням. Чем больше эта константа, тем сильнее комплекс диссоциирует и тем менее он устойчив.
Процессы образования комплексных ионов являются ступенчатыми. Каждая ступень образования комплексного иона, например [PbI+], описывается уравнением реакции образования
Pb2+ + I– 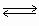 [PbI]+
[PbI]+
и ступенчатой константой устойчивости bi, где i соответствует числу лигандов в образовавшемся комплексном ионе (в данном случае i = 1):
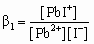 .
.
Вторая ступень образования комплекса
[PbI+] + I-  [PbI2]
[PbI2]
характеризуется второй ступенчатой константой устойчивости b2:
 .
.
Третья ступень образования комплексного иона
[PbI2] + I–  [PbI3]–
[PbI3]–
характеризуется третьей ступенчатой константой устойчивости b3:
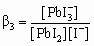 .
.
Произведение трех констант устойчивости обозначается b1–3 и равно
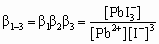 .
.
В химических расчетах и оценках находят применение и так называемые общие константы устойчивости, которые характеризуют комплексные соединения с максимально известным координационным числом. Однако применение общих констант устойчивости не всегда оказывается правильным.
Наряду с константами устойчивости находят применение и константы нестойкости KH, которые относятся не к уравнениям образования, а к уравнениям диссоциации комплексных ионов и молекул. Численно константы нестойкости являются обратными величинами по отношению к константам устойчивости:  KH1 характеризует равновесие диссоциации комплексного иона с координационным числом, равным 1; например для азидных комплексов Fe3+ это есть равновесие диссоциации Fe(N3)2+:
KH1 характеризует равновесие диссоциации комплексного иона с координационным числом, равным 1; например для азидных комплексов Fe3+ это есть равновесие диссоциации Fe(N3)2+:
Fe(N3)2+ 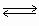 Fe3+ +
Fe3+ + 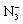 ;
;
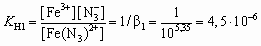 .
.
Общая константа нестойкости для азидных комплексов Fe3+ относится к уравнению диссоциации и имеет вид:
[Fe(N3)5]2– 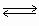 Fe3+ + 5
Fe3+ + 5 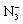 ;
;
 .
.
Влияние различных факторов на устойчивость комплексов и их диссоциацию. Степень диссоциации зависит от концентрации раствора слабого электролита. При разбавлении степень диссоциации всегда увеличивается, т.к. увеличивается число молекул растворителя на одну молекулу растворенного вещества. По принципу Ле Шателье равновесие электролитической диссоциации в этом случае должно сместиться в направлении образования продуктов.
Степень электролитической диссоциации зависит от температуры раствора. Обычно при увеличении температуры степень диссоциации растет, т.к. активируются связи в молекулах, они становятся более подвижными и легче ионизируются. Концентрацию ионов в растворе слабого электролита можно рассчитать, зная степень диссоциации и исходную концентрацию вещества c в растворе.
В растворах комплексных соединений существует система динамических равновесий, т. е. комплексные соединения подвержены в значительной степени электролитической диссоциации. Ионы или молекулы, находящиеся во внешней сфере, связаны в комплексном соединении гораздо слабее, чем ионы или молекулы, находящиеся во внутренней сфере. Такая различная прочность связи обусловливает характер диссоциации комплексных соединений.
Вычисление концентрации иона-комплексообразователя в растворе комплексной соли и избытке лиганда.Числовые значения констант нестойкости могут быть использованы для вычисления концентрации свободных ионов комплексообразователя и лигандов в растворах комплексных соединений. Если эти концентрации известны, то путем математических вычислений можно выяснить, каким реагентом эти ионы могут быть осаждены в виде малорастворимых соединений или связаны в виде малодиссоциированных веществ.
35. 36. Комплексонометрия. Определение содержания Ca и Mg в растворе. Реакции. Условия проведения титрования, индикаторы, формулы.Комплексные соединения - это соединения, которые характеризуются наличием хотя бы одной ковалентной связи, возникшей по донорно-акцепторному механизму.
Комплексонометрия (трилонометрия) — титриметрический метод, основанный на реакциях образования комплексных соединений ионов металлов с этилендиаминтетрауксусной кислотой и другими аминополикарбоновыми кислотами (комплексонами). Большинство ионов металлов взаимодействуют с комплексонами практически мгновенно с образованием растворимых в воде малодиссоциированных соединений постоянного состава. Метод позволяет определять практически все катионы и многие анионы. Комплексонометрия является составной частью комплексиметрии (хелатометрии).
Комплексонометрия предъявляет высокие требования к чистоте применяемых реактивов и дистиллированной воды, в качестве которой лучше применять бидистиллят, полученный в аппарате из химически стойкого стекла.
В комплексонометрии применяют индикаторы, дающие окрашенное соединение с определяемым ионом. Примером такого индикатора служит эриохром черный Т ( кислотный хром черный специальный), который с ионами магния, кальция и некоторыми другими образует комплексы, интенсивно окрашенные в винно-красный цвет. Раствор не связанного в комплекс индикатора окрашен в синий цвет. Переход окраски от винно-красной к синей отчетлив, поэтому эриохром черный Т является чувствительным индикатором.
В комплексонометрии определяемый металл часто присутствует в титруемом растворе не только в виде свободного иона Mv или хелатного комплекса MZ - , но и в виде других комплексов, образованных этим металлом, например аммиачных, если титрование проводится в аммиачном растворе ( аммиак обычно прибавляю.
В комплексонометрии используют методы прямого, обратного и заместительного титрования. Наиболее часто используют прямое титрование: большинство металлов можно определить прямым титрованием раствором ЭДТА
В комплексонометрии, как и в других уже рассмотренных способах титрометрического анализа, протяженность эквивалентного участка кривой титрования зависит от концентрации растворов определяемого компонента и титранта и увеличивается при работе с более концентрированными растворами. Кроме того, она сильно зависит от константы устойчивости образуемого комплексоната, значительно увеличиваясь при ее возрастании.
Типичные комплексообразователи:
- d-элементы периодической системы элементов, их катионы Zn2+, Fe2+, Fe3+, Co3+, Ni2+, Cu2+ и т.д.;
- некоторые неметаллы, например, в H2SO4 → S, [NH4]Cl → N, H2[SiF6] → Si.
Важнейшие лиганды:
- нейтральные молекулы дипольного характера: NH3, NO, CO и др.
- ионы:CN-, NO2-, Cl-, Br-, OH-, CO32- и др.
ЭДТУ- этилендиаминтетрауксусная кислота (комплексон II)
ЭДТА – этилендиаминтетрауксусной кислоты динатриевая соль (комплексон III)-ТРИЛОН Б
|
из
5.00
|
Обсуждение в статье: Определение содержания хлоридов в растворе методом Мора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

