 |
Главная |
V. ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛА
|
из
5.00
|
Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из внешней среды. «Узнавание» сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора.
Если сигнал воспринимается мембранным рецепторами, то схему передачи информации можно представить так:
• взаимодействие рецептора с сигнальной млекулой (первичным посредником);
• активация мембранного фермента, ответственного за образование вторичного посредника;
• образование вторичного посредника цАМФ, цГМФ, ИФ3, ДАГ или Са2+;
• активация посредниками специфических белков, в основном протеинкиназ, которые, в свою очередь, фосфорилируя фермент оказывают влияние на активность внутриклеточных процессов.
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов.
А. сигнальные молекулы — гормоны, МЕДИАТОРЫ, ЭЙКОЗАНОИДЫ, ФАКТОРЫ РОСТА, ОКСИД АЗОТА (N0)
Сигнальными молекулами могут быть неполярные и полярные вещества. Неполярные вещества, например стероидные гормоны, проникают в клетку, проходя через липидный бислой. Полярные сигнальные молекулы в клетку не проникают, но связываются специфическими рецепторами клеточных мембран. Такое взаимодействие вызывает цепь последовательных событий в самой мембране и внутри клетки. К полярным сигнальным молекулам относят белковые гормоны (например, глюкагон, инсулин, паратгормон), нейромедиаторы (например, ацетилхолин, глицин, γ-аминомасляная кислота), факторы роста, цитокины, эйкозаноиды.
Б. рецепторы
По локализации различают мембранные, цитоплазматические и ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах миллисекунд) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы. Рецепторы первого типа — интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал (рис. 5-29).
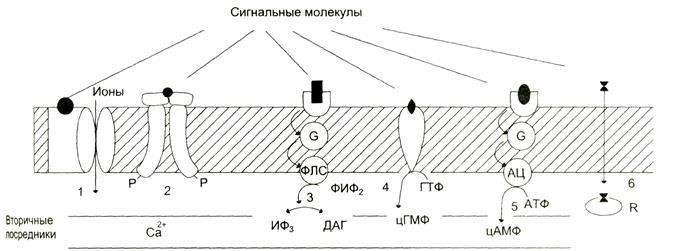
Рис. 5-29. Участие рецепторов в трансмембранной передаче сигнала.Рецепторы: 1 — связанные с ионными каналами, например рецептор ГАМК; 2 — с каталитической активностью (рецептор инсулина); 3 — передающие сигнал на фосфолипазу С, например α,-адренорецептор; 4— с каталитической активностью (гуанилатциклаза, рецептор ПНФ); 5— передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 — связывающие гормон в цитозоле или ядре, например рецептор кортизола. пнф - предсердный натрийуретический фактор
Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы,обладающие собственной тирозинкиназной или гуанилатциклазной активностью, и рецепторы,взаимодействующие через G-белок с мембранным ферментом. Связывание лиганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т.е. через мембрану переносится информация, а не заряды или какие-либо растворённые молекулы.
В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро.
Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т.д.) клеток-мишеней.
1. Рецепторы адреналина — адренорецепторы
Адренорецепторы различают по распределению в организме — центральные и периферические. Центральные адренорецепторы, локализованные в различных областях мозга, участвуют в регуляции функций ЦНС, периферические — контролируют работу внутренних органов.
Все адренорецепторы классифицируют на два типа — α- и β-, но каждый тип имеет несколько подтипов, наиболее распространённые из них — α1-, α2-, β1 и β2-рецепторы. В зависимости от своего анатомического расположения клетки одного типа, например гладко-мышечные клетки сосудов или адипоциты, содержат разные типы рецепторов.
Несмотря на значительное подобие между α- и β-рецепторами и их подтипами, они кодируются разными генами. Адренорецепторы принадлежат к семейству белков, имеющих 7 трансмембранных α-спиралей (которые принято называть доменами). Длина N- и С-концов, а также длина 1—4 доменов различается у разных типов и подтипов рецепторов (рис. 5-30).
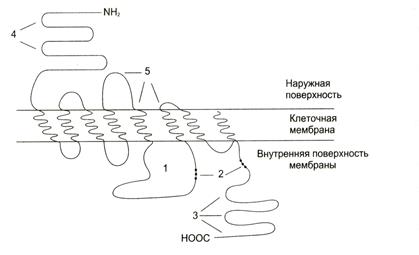 рис. 5-30. Мембранная организацияβ2-адренорецептора.
рис. 5-30. Мембранная организацияβ2-адренорецептора.
1 — фрагмент рецептора, участвующий в связывании Gs-белка; 2, 3 — участки возможного фосфорилирования протеинкиназой А (2) и киназой β-адренорецептора (3); 4 — участок гликозилирования; 5 — участок связывания адреналина.
Адренорецепторы — гликопротеины, включающие в свой состав различные углеводные фрагменты. Гликозилированию подвергаются расположенные в области N-конца остатки аспарагиновой кислоты.
β-Адренорецепторы встречаются практически во всех тканях организма. Количество β-адренорецепторов, приходящееся на клетку, варьирует от 300 до 4000.
Центр связывания адреналина образован аминокислотными остатками третьего, пятого и шестого доменов. Другой функционально важный центр — область взаимодействия с G-белками, участвующими в формировании клеточного ответа. Остатки серина и треонина в области третьего внутреннего домена и С-конца адренорецептора могут фосфорилироваться под действием протеинкиназы А или специфической киназой β-адренорецептора. Фосфорилирование приводит к изменению конформации рецептора и снижению сродства к G -белку или препятствует связыванию с G -белком.
α-Адренорецепторы различают по локализации (например, гепатоциты имеют α1 -рецепторы, адипоциты — α2-адренорецепторы) и механизму трансформации биологического сигнала. Эффекторные системы, связанные с α1- и α2-адренорецепторами, включают G-белки разного типа - Gр1с-белки (G-белок стимулирующий) и Gi-белки (G-белок ингибирующий) и соответственно ферменты - фосфолипазу С или аденилатциклазу.
2 Рецепторы с тирозинкиназной активностью
Тирозиновые протеинкиназы - ферменты, реформирующие специфические белки по тирозину, подразделяют на 2 типа — мембранные (рецепторные) и цитоплазматические. Внутриклеточные тирозиновые протеинкиназы прининимают участие в процессах передачи сигнала в ядро. Рецепторные тирозиновые протеинкиназы участвуют в трансмембранной передаче сигналов.
Примером рецепторной тирозиновой протеинкиназы может служить рецептор инсулина (рис. 5-31).
Рис. 5-31. Активация рецептора инсулина — тирозиновой протеинкиназы.
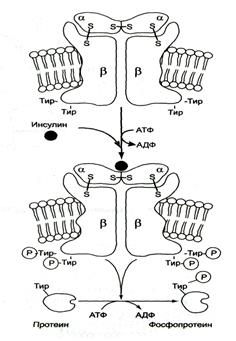 Рецептор инсулина — тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина.
Рецептор инсулина — тирозиновая протеинкиназа, фосфорилирующая белки по ОН-группам тирозина.
Рецептор состоит из двух α- и двух β-субъедиц, связанных дисульфидными связями и нековалентными взаимодействиями. α- и β-Субъединицы — гликопротеины с углеводной цепью на наружной стороне мембраны. Вне мембраны на её поверхности находятся α-субъединицы. Центр связывания инсулина образован N-концевыми доменами α-субъединиц. β-Субъединицы пронизывают мембранный бислой и не участвуют в связывании инсулина.
Каталитический центр тирозиновой протеинкиназы находится на внутриклеточных доменах β-субъединиц. В отсутствие гормона инсулиновые рецепторы не проявляют тирозинкиназной активности. Присоединение инсулина к центру связывания на α-субъединицах активирует фермент, причём субстратом служит сама тирозиновая протеинкиназа (β-субъединицы), т.е. происходит фосфорилирование β-субъединицы по нескольким тирозиновым остаткам. Фосфорилирование β-субъединиц происходит по механизму межмолекулярного трансфосфорилирования, т.е. ода β-цепь фосфорилирует другую β-цепь той же молекулы рецептора. Это, в свою очередь, приводит к изменению субстратной специфичности тирозиновой протеинкиназы; теперь она способна фосфорилировать другие внутриклеточные белки. Активация и изменение специфичности обусловлены конформационными изменениями рецептора инсулина после связывания гормона и аутофосфорилирования.
Ключевой белок, фосфорилируемый тирозиновой протеинкиназой, — субстрат инсулинового рецептора-1 (от англ. Insulin receptor substrate IRS-1). Фосфорилированный IRS-1 активирует ферменты, например тирозиновую фосфопротеинфосфатазу, и белки, участвующие в регуляции клеточных процессов.
Дефосфорилирование рецептора под действием тирозиновой фосфопротеинфосфатазы возвращает его в неактивное состояние. Сродство рецептора к инсулину снижается при его фосфорилировании протеинкиназой А по аминокислотным остаткам серина и треонина.
|
из
5.00
|
Обсуждение в статье: V. ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

